
 在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大.则所用试剂分别可能依次是( )
在甲、乙两个装置中,胶头滴管中吸入某种液体,烧瓶中充入(或放入)另一种物质,挤压胶头滴管,加入液体,一段时间后两装置中的气球都有明显胀大.则所用试剂分别可能依次是( )| A. | 甲:浓硫酸和木炭 乙:浓氨水和SO2 | |
| B. | 甲:双氧水和MnO2 乙:饱和食盐水和HCl | |
| C. | 甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2 | |
| D. | 甲:浓硫酸和蔗糖(滴有几滴水) 乙:氯化亚铁溶液和硫化氢 |
分析 甲装置气球膨大原因是烧瓶内有气体生成或者温度升高,使烧瓶内的压强大于外界压强;乙装置气球膨大原因是烧瓶内的气体参加反应或者温度降低,使烧瓶内的压强小于外界压强,结合对应的物质的性质解答该题.
解答 解:A.甲中稀硫酸和木炭不反应,二者应在加热条件下反应,则甲压强不变,故A错误;
B.甲中双氧水在二氧化锰的催化下迅速反应生成氧气,使容器内压强大于大气压,所以气球变大;乙中氯化氢溶于饱和食盐水,装置内压强减小,气球变大,故B正确;
C.苯酚和Na2CO3溶液不生成气体,则甲压强不变,故C错误;
D.甲中浓硫酸稀释放出大量的热,且具有强的氧化性和吸水性,能够使蔗糖碳化且发生氧化还原反应生成二氧化碳、二氧化硫,烧瓶内气体增加,压强增大,气体胀大,且乙中氯化亚铁溶液和硫化氢,使烧瓶内气体体积减小,压强减小,气球胀大,故D正确;
故选BD.
点评 本题考查实验装置的综合应用及元素化合物知识,为高频考点,把握物质的性质和气球膨胀的原理是解题关键,侧重分析与应用能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 126C和146C是两种核素 | |
| B. | 纤维素和淀粉互为同分异构体 | |
| C. | CH3COOCH2CH3和CH3CH2OOCCH3是同物质 | |
| D. | CH3CH2COOH可看成是由-C2H5和-COOH两种基团组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
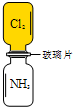 室温下,抽取图两瓶体积相等的氯气和氨气之间的玻璃片后,立即观察到有浓郁白烟,同时一瓶中黄绿色迅速褪去.充分反应后体系中的还原产物是( )
室温下,抽取图两瓶体积相等的氯气和氨气之间的玻璃片后,立即观察到有浓郁白烟,同时一瓶中黄绿色迅速褪去.充分反应后体系中的还原产物是( )| A. | NH4Cl | B. | HCl | C. | N2 | D. | H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素符号 | X | Y | Z | R | T |
| 原子半径(nm) | 0.160 | 0.111 | 0.104 | 0.143 | 0.066 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
| A. | 单质与稀硫酸反应的速率快慢:R>Y>X | |
| B. | 离子半径:T2->X2+ | |
| C. | 元素最高价氧化物对应的水化物的碱性:Y>R>X | |
| D. | 相同条件下,等物质的量的单质与氢气化合放出能量的多少:T>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com