
【题目】![]() 时,在
时,在![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如下表所示。下列说法不正确的是
的浓度随时间变化如下表所示。下列说法不正确的是
时间 |
|
|
|
| 6 | 0 | ? |
| 3 | 1 |
|
A.![]() 时间内
时间内![]()
B.![]() 时,若升高温度或再充入
时,若升高温度或再充入![]() 气体,都可以提高
气体,都可以提高![]() 的转化率
的转化率
C.![]() 时,
时,![]() 正
正![]() 逆
逆![]()
D.![]() 时,平衡常数
时,平衡常数![]() ,
,![]() 与
与![]() 的转化率相等
的转化率相等
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则α____(填“<”“>”或“=”)1×10-14,作出此判断的理由是___________________。
(2)25 ℃下,某Na2SO4溶液中c(![]() )=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
)=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)t2 ℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的排列顺序是_____________________。
(4)相同温度下等物质的量浓度的下列溶液中,
A、NH4Cl B、NH4HCO3 (溶液呈碱性) C、NH4HSO4 D、(NH4)2SO4
NH4+离子浓度由大到小的顺序是_______________(用对应的字母填写)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.MgH2拥有很高的储氢密度,相对便宜的价格以及良好的可逆储氢性能,在储氢材料中具有重要作用和地位,一直都是广大研究者关注的焦点。回答下列问题:
(1)请写出MgH2的电子式:___________________。
(2)MgH2能与H2O反应生成白色沉淀Mg(OH)2和H2,NH3与H2O类似,MgH2与NH3反应也生成氢气,反应原理类似,请写出反应的化学方程式_____________。
Ⅱ.(3)甲铵(H2NCOONH4,氨基甲酸铵,简称甲铵),在不同条件下分解的能量变化如图所示,ΔH=__________________kJ·mol1。

Ⅲ.氨呈弱碱性,氨燃料与碱性燃料电池是一对较好的组合。直接氨碱性(膜)燃料电池总的化学方程式为:4NH3+3O2=2N2+6H2O,工作原理如图:
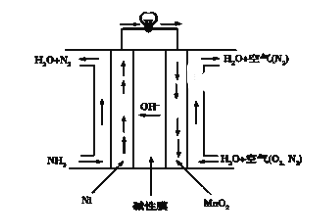
(4)MnO2电极为________________极(填“正”“负”“阴”或“阳”),写出Ni电极的电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2L的恒温恒容密闭容器中充入2mol SO2和1mol O2,发生反应2SO2(g)+O2(g) ![]() 2SO3(g) △H=-Q kJ·mol-l (Q>O),下列有关说法不正确的是
2SO3(g) △H=-Q kJ·mol-l (Q>O),下列有关说法不正确的是
A. 反应达到平衡时,放出热量为QkJ
B. 若容器的压强不再发生交化,则反应达到平衡
C. 反应过程中c(SO2)+ c(SO3)=1 mol·L-1恒成立
D. 平衡时,SO2、O2的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生反应并达到平衡:3X(g) + Y(g)![]() 2Z(g) △H<0。若测得平衡时X的转化率为37.5 %,Y的转化率是X的2/3,则下列叙述正确的是
2Z(g) △H<0。若测得平衡时X的转化率为37.5 %,Y的转化率是X的2/3,则下列叙述正确的是
A. 若以X表示的反应速率为0.2 mol/(L·s),则以Z表示的反应速率为0.3 mol/(L·s)
B. 充入氦气增大容器内的压强,Y的转化率提高
C. 升高温度,平衡向正反应方向移动
D. 起始时刻n(X) : n(Y)= 2 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g) △H= -1367.0 kJ/mol(燃烧热)
B.S(s)+O2(g)= SO2(g) △H= -269.8kJ/mol(反应热)
C.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) △H= +57.3kJ/mol(中和热)
D.2NO2 = O2+2NO △H= +116.2kJ/mol(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在生产、生活中有着重要的应用价值。请按要求回答下列问题。
(1)如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统![]() Ⅰ
Ⅰ![]() 和系统
和系统![]() Ⅱ
Ⅱ![]() 制氢的热化学方程式分别为______;______;制得等量
制氢的热化学方程式分别为______;______;制得等量![]() 所需能量较少的是系統______。
所需能量较少的是系統______。
(2)![]() 与
与![]() 在高温下发生反应:
在高温下发生反应:![]() 。在
。在![]() 时,将
时,将![]() 与
与![]() 充入
充入![]() 的空钢瓶中。
的空钢瓶中。
①该反应平衡后![]() 的物质的量分数为
的物质的量分数为![]() ,
,![]() 的平衡转化率
的平衡转化率![]() ______,反应平衡常数
______,反应平衡常数![]() ______。
______。
②在![]() 重复试验,平衡后
重复试验,平衡后![]() 的物质的量分数为
的物质的量分数为![]() ,
,![]() 的转化率a2______a1,
的转化率a2______a1,![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 该反应的
该反应的![]() ______0。
______0。
③测定钢铁中硫含量:将钢铁中的硫转化为![]() ,然后用一定浓度的
,然后用一定浓度的![]() 溶液进行滴定,所用指示剂为______,滴定反应的离子方程式为______。
溶液进行滴定,所用指示剂为______,滴定反应的离子方程式为______。
已知![]() 时,
时,![]() 的电离常数
的电离常数![]() ,
,![]() ,则该温度下
,则该温度下![]() 的水解平衡常数
的水解平衡常数![]() ______。若向
______。若向![]() 溶液中加入少量的
溶液中加入少量的![]() ,则溶液中
,则溶液中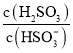 将______
将______![]() 填“增大”、“减小”或“不变“
填“增大”、“减小”或“不变“![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为5 L的密闭容器中,进行如下化学反应: CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T /℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =______________。
(2)该反应为____________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是________________。
a 容器中压强不变 b 混合气体中 c(CO)不变
c υ正(H2)=υ逆(H2O) d c (CO2)=c (CO)
(4)830℃下,若物质的浓度关系是c (CO2)·c (H2) > c (CO)·c (H2O),则此时正反应速率与逆反应速率的关系是____________。
a υ正 > υ逆 b υ正 = υ逆 c υ正 < υ逆 d 无法判断
(5)若开始时向该容器中加入CO2和H2各0.1 mol,在830℃和催化剂存在的条件下,反应达到平衡时,水蒸气的物质的量浓度c(H2O)=_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化均能一步实现的组合是
A.SiO2(s) ![]() SiCl4(g)
SiCl4(g) ![]() Si(s)
Si(s)
B.Fe3O4(s) ![]() Fe(s)
Fe(s) ![]() FeCl2(s)
FeCl2(s)
C.AgNO3(aq) ![]() [Ag(NH3)2]+
[Ag(NH3)2]+![]() Ag(s)
Ag(s)
D.Al2O3(s) ![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3(s)
Al(OH)3(s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com