
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1 H2C2O4溶液 | 30mL 0.01mol?L-1 KMnO4溶液 |
| ② | 20mL 0.2mol?L-1 H2C2O4溶液 | 30mL 0.01mol?L-1 KMnO4溶液 |

| 4.48×10-3L |
| 22.4L/mol |
| n |
| V |
| 0.00026mol |
| 0.05L |


科目:高中化学 来源: 题型:
| A、是否能透过滤纸 |
| B、分散质粒子直径的大小 |
| C、是否会产生丁达尔效应 |
| D、是否为均一、稳定、透明的外观 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室中用稀盐酸与石灰石反应制取CO2 |
| B、实验室中用高锰酸钾加热分解制取O2 |
| C、实验室中用浓盐酸与二氧化锰加热制取Cl2 |
| D、实验室中用稀硫酸与锌粒反应制取H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
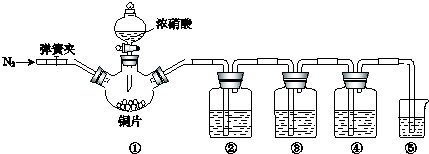
| 实验过程 | 实验现象 |
| Ⅰ.检验装置的气密性 | \ |
| Ⅱ.… | \ |
| Ⅲ.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | ①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无色,通过④后变为红棕色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知Fe与S能直接化合得FeS,推测Cu与S化合直接化合生成CuS |
| B、已知H2O比H2S的沸点高,推测H2S比H2Se的沸点高 |
| C、已知A12S3不能在水溶液中存在,推测Mg3N2不能在水溶液中存在 |
| D、已知工业上用电解熔化的NaCl制取Na,推测用熔化的A1C13制取Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com