
| A£® | øł¾ŻµŚ¢Ł²½·“Ó¦æÉÖŖ»¹ŌŠŌ£ŗCr3+“óÓŚFe2+ | |
| B£® | µŚ¢Ś²½¹żĀĖµĆµ½µÄĀĖŌüÖŠÖ÷ŅŖ³É·ÖĪŖCr£ØOH£©3”¢Fe£ØOH£©2£¬²»ŗ¬Fe£ØOH£©3 | |
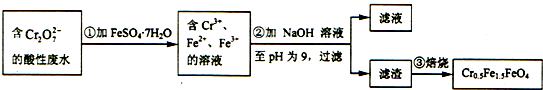
| C£® | ÓūŹ¹1LøĆ·ĻĖ®ÖŠµÄCr2O72-ĶźČ«×Ŗ»ÆĪŖCr0.5Fe1.5FeO4£¬ĄķĀŪÉĻŠčŅŖ¼ÓČė27.8g FeSO4•7H2O | |
| D£® | µŚ¢Ū²½øßĪĀ±ŗÉÕ¹ż³ĢÓƵ½µÄÖ÷ŅŖŹµŃéŅĒĘ÷ÖŠŹōÓŚ¹čĖįŃĪÖŹµÄÓŠ£ŗ¾Ę¾«µĘ”¢Õō·¢Ćó”¢ÄąČż½Ē |
·ÖĪö Cr2O72-ÓŠ½ĻĒæŃõ»ÆŠŌ£¬FeSO4•7H2OÖŠFe2+ÓŠŅ»¶ØµÄ»¹ŌŠŌ£¬ŌŚĖįŠŌ½éÖŹÖŠ·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬ÓÉŹµŃéĮ÷³ĢæÉÖŖ£¬µŚ¢Ł²½·“Ó¦ÖŠCr2O72-ŌŚĖįŠŌĢõ¼žĻĀ½«Fe2+Ńõ»ÆĪŖFe3+£¬×ŌÉķ±»»¹ŌĪŖCr3+£¬¼ÓČėNaOHČÜŅŗµ÷½ŚČÜŅŗpHĪŖ9£¬µĆµ½Cr£ØOH£©3”¢Fe£ØOH£©2”¢Fe£ØOH£©3£¬¹żĀĖµÄĀĖŌü¾±ŗÉÕµĆµ½Cr0.5Fe1.5FeO4£¬ŅŌ“Ė½ā“šøĆĢā£®
½ā“š ½ā£ŗCr2O72-ÓŠ½ĻĒæŃõ»ÆŠŌ£¬FeSO4•7H2OÖŠFe2+ÓŠŅ»¶ØµÄ»¹ŌŠŌ£¬ŌŚĖįŠŌ½éÖŹÖŠ·¢ÉśŃõ»Æ»¹Ō·“Ó¦£¬ÓÉŹµŃéĮ÷³ĢæÉÖŖ£¬µŚ¢Ł²½·“Ó¦ÖŠCr2O72-ŌŚĖįŠŌĢõ¼žĻĀ½«Fe2+Ńõ»ÆĪŖFe3+£¬×ŌÉķ±»»¹ŌĪŖCr3+£¬¼ÓČėNaOHČÜŅŗµ÷½ŚČÜŅŗpHĪŖ9£¬µĆµ½Cr£ØOH£©3”¢Fe£ØOH£©2”¢Fe£ØOH£©3£¬¹żĀĖµÄĀĖŌü¾±ŗÉÕµĆµ½Cr0.5Fe1.5FeO4£¬
A£®µŚ¢Ł²½·“Ó¦ÖŠCr2O72-ŌŚĖįŠŌĢõ¼žĻĀ½«Fe2+Ńõ»ÆĪŖFe3+£¬×ŌÉķ±»»¹ŌĪŖCr3+£¬·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖCr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O£¬»¹ŌŠŌCr3+Š”ÓŚFe2+£¬¹ŹA“ķĪó£»
B£®ÓÉĢāøųæņĶ¼æÉÖŖ£¬Fe2+¹żĮ棬¼ÓNaOHŹ±£¬²śÉśCr£ØOH£©3”¢Fe£ØOH£©3ŗĶFe£ØOH£©2ČżÖÖ³ĮµķĪļ£¬¹ŹB“ķĪó£»
C.1 L·ĻĖ®ÖŠŗ¬n£ØCr2O72-£©=1.00”Į10-2 mol£®øł¾ŻCrŌ×Ó”¢FeŌ×ÓŹŲŗć£¬æÉµĆ£ŗ
Cr2O72-”«”«”«4Cr0.5Fe1.5FeO4”«”«”«10FeSO4•7H2O£¬
ĖłŅŌĄķĀŪÉĻn£ØFeSO4•7H2O£©=10n£ØCr2O72-£©=1.00”Į10-2 mol”Į10=0.1 mol£¬
ĖłŅŌm£ØFeSO4•7H2O£©=0.1 mol”Į278 g/mol=27.8 g£¬¹ŹCÕżČ·£»
D£®¼ÓČė¹ĢĢ壬ӦŌŚŪįŪöÖŠ½ųŠŠ£¬²»ÄÜÓĆÕō·¢Ć󣬹ŹD“ķĪó£®
¹ŹŃ”C£®
µćĘĄ ±¾ĢāŅŌ¹¤Ņµ·ĻĖ®“¦ĄķĪŖŌŲĢå×ŪŗĻæ¼²éĪļÖŹµÄÖʱøŗĶ·ÖĄė£¬ĪŖøßĘµæ¼µć£¬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦”¢ŹµŃéÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦µÄ漲飬ĢāÄæÉę¼°Ńõ»Æ»¹Ō·“Ó¦”¢Ąė×Ó·“Ó¦”¢¹ŲĻµŹ½¼ĘĖćµČ£¬ÄѶČÖŠµČ£¬¹Ų¼üøł¾ŻŹµŃéĮ÷³ĢĄūÓĆŃõ»Æ»¹Ō·“ӦŊ¶Ļ·¢ÉśµÄĄė×Ó·“Ó¦£¬ŹĒ¶Ōѧɜ×ŪŗĻÄÜĮ¦µÄ漲飮ŹĒŅ»µĄ²»“ķµÄÄÜĮ¦æ¼²éĢā£¬ÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | H2 ŗĶ D2 »„ĪŖĶ¬Ī»ĖŲ | |
| B£® | CH3-CH2-NO2ŗĶH2N-CH2-COOH»„ĪŖĶ¬·ÖŅģ¹¹Ģå | |
| C£® | ¼×±½ŗĶ 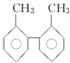 »„ĪŖĶ¬ĻµĪļ »„ĪŖĶ¬ĻµĪļ | |
| D£® | ½šøÕŹÆ”¢ŹÆÄ«ŗĶ”°×ćĒņĻ©”±£Ø·Ö×ÓŹ½ĪŖ C60£©ĪŖĶ¬ĖŲŅģŠĪĢå |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NH3 | B£® | N2 | C£® | CO2 | D£® | H2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øßĢśĖį¼Ų£ØK2FeO4£©ŹĒŅ»ÖÖŠĀŠĶ”¢øߊ§”¢¶ą¹¦ÄÜĖ®“¦Ąķ¼Į£¬¼ČÄÜɱ¾śĻū¶¾ÓÖÄܾ»Ė® | |
| B£® | ”°¹ā»ÆѧŃĢĪķ”±”¢”°³ōŃõæÕ¶“”±µÄŠĪ³É¶¼ÓėµŖŃõ»ÆŗĻĪļÓŠ¹Ų | |
| C£® | Ź¹ÓĆŗ¬12CµÄ²śĘ·£¬¼õÉŁŹ¹ÓĆŗ¬13C»ņ14CµÄ²śĘ··ūŗĻ”°“Ł½ųµĶĢ¼¾¼Ć”±×ŚÖ¼ | |
| D£® | øß“æ¶ČµÄ¶žŃõ»Æ¹č¹ć·ŗÓĆÓŚÖĘ×÷¹āµ¼ĻĖĪ¬£¬¹āµ¼ĻĖĪ¬ÓöĒæ¼ī»į”°¶ĻĀ·”± |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČÜŅŗÖŠPb2+ŗĶI-ÅØ¶Č¶¼Ōö“ó | B£® | ČܶȻż³£ŹżKspŌö“ó | ||
| C£® | ³ĮµķČܽāĘ½ŗāĻņÄęĻņŅĘ¶Æ | D£® | PbI2µÄČܽā¶Č²»±ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬22.4LøżĶéĶźČ«Č¼ÉÕÉś³É¶žŃõ»ÆĢ¼·Ö×ÓŹżĪŖ8NA | |
| B£® | 28æĖÓÉC3H6ŗĶC4H8×é³ÉµÄ»ģŗĻĘųĢåÖŠŗ¬¹²ÓƵē×Ó¶ŌŹżÄæĪŖ6NAøö | |
| C£® | 0.1molŃõĘų×÷ĪŖŃõ»Æ¼ĮµĆµ½µē×ӵďżÄæŅ»¶ØĪŖ0.4NA | |
| D£® | ³£ĪĀĻĀ£¬0.1mol•L-1µÄĢ¼ĖįÄĘČÜŅŗÖŠŗ¬ÓŠµÄŅõĄė×ÓŹż“óÓŚ0.1NA |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com