
在一定条件下(不需添加别的反应物),经不同的化学反应,可实现如下图的各种变化。其中,⑤是工业生产中的一个重要反应,反应③④属氧化还原反应,而反应①、②属非氧化还原反应。A为正盐,B为无色无味的气体,X、F和Y均为气体单质,化合物D、H都是三角锥形的极性分子,F是空气的主要成份之一,其余为化合物,据此请填空:

(1) 物质A可能是 (填化学式),F单质的结构式为 ,
(2) W中所含化学键的类型有 ,
(3) B和C的分子的立体结构分别是: 和 ,
(4) 指出化合物D中中心原子的杂化类型 。
科目:高中化学 来源: 题型:
四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中的水蒸气即产生“白烟”(TiCl4+H2O===TiOCl2+2HCl↑)。在650~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。如图是某科研小组制备TiCl4的反应装置,其主要操作步骤如下:
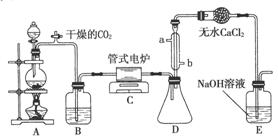
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
(1)正确的操作顺序为(填序号)________。
(2)C装置中的反应的化学方程式为_________________________________。
(3)B中的试剂为________;其作用是__________________________。
(4)D装置的作用是_________________________________________。
(5)干燥管中无水CaCl2的作用是_____________________________。
(6)从环境保护的角度,提出一个优化方案:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
诺贝尔生理和医学奖的最大一次失误是1948年授予了瑞士化学家米勒,由于米勒发明了剧毒有机氯杀虫剂DDT而获得当年诺贝尔奖,但后来发现DDT是一种难降解的化合物,毒性残留时间长,现世界各国现已明令禁止生产和使用。DDT的结构简式为 ,下列关于DDT的说法中正确的是:
A.DDT分子中两苯环不可能共平面
B.DDT分子属于芳香烃
C.若使原苯环上的两个氯原子连接在同一个苯环上,共有6种同分异构体
D.DDT难以降解的原因是DDT难以发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为第三周期元素,X的第一电离能在同周期中最小,Y的电负性在同周期中最大,Z的离子半径在同周期中最小,下列关于X、Y、Z叙述中不正确的是:( )
A.原子序数和原子半径大小顺序均为:X<Y<Z
B.元素X与元素Y能形成离子化合物
C.元素Z最高价氧化物对应水化物具有两性
D.元素Y形成的气态氢化物水溶液呈强酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是:( )
A.CH4和NH 是等电子体,键角均为60°
是等电子体,键角均为60°
B.B3N3H6和苯是等电子体,1molB3N3H6和苯均有6mol非极性键
C.CH4和P4均为正四面体结构,故二者是等电子体
D.BF3和CO 是等电子体,均为平面三角形结构
是等电子体,均为平面三角形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.任何化学反应,均可以设计成原电池
C.氢氧燃料电池可以把化学能转化为电能
D.在锌锰干电池中,锌筒是负极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氯水的叙述正确的是 ( )
①新制氯水中只含有Cl2和H2O分子
②新制氯水可使蓝色石蕊试纸先变红后褪色
③光照新制氯水有气泡逸出,该气体是Cl2
④新制氯水放置数天后,酸性减弱(不考虑挥发性)
⑤新制的氯水呈黄绿色,久置的氯水无色
⑥新制的氯水漂白作用强,而久置的氯水无漂白作用
⑦新制的氯水所含成分多,而久置的氯水所含成分少
⑧新制的氯水中无氯离子,而久置的氯水中则含氯离子
A.②⑤⑥⑦ B.②③④⑤
C.③⑤⑥⑧ D.①③④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
核磁共振氢谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同。现有一物质的核磁共振氢谱如图所示:
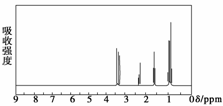
则该物质可能是下列中的( )
A.CH3CH2CH3 B.CH3CH2CH2OH C.CH3CH2CH2CH3 D.CH3CH2CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修3:物质结构与性质](15分)
已知:A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;D的基态原子的M电子层上有4个未成对电子。
请回答下列问题:
(1)D是元素周期表中第________周期,第________族的元素;其基态原子的外围电子排布式为________。
(2)A、B、C、D四种元素中,电负性最大的是________(填元素符号)。
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为________。B的氢化物的沸点远高于A的氢化物的沸点的主要原因是_____________________________________________________________
_____________________________________________________________。
(4)D能与AC分子形成D(AC)5,其原因是AC分子中含有________________。D(AC)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断D(AC)5晶体属于________(填晶体类型)。
(5)SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞。再在每两个相邻的Si原子(距离最近的两个Si原子)中心连线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有________个Si原子,________个O原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com