
| A. | 将海水蒸馏淡化为饮用水 | |
| B. | 四氯化碳萃取碘水中的碘 | |
| C. | 过滤除去粗盐溶液中的不溶性杂质 | |
| D. | 三氯化铁溶液滴入沸水中可制得氢氧化铁胶体 |
分析 A.因盐类物质的沸点比水高,则从海水中获得淡水,根据物质沸点的差异;
B.从碘水中萃取碘单质,没有新物质生成;
C.过滤的方法是利用溶解度的不同;
D.三氯化铁浓溶液滴入沸水中,铁离子水解生成氢氧化铁胶体和H+.
解答 解:A.因盐类物质的沸点比水高,则从海水中获得淡水,根据物质沸点的差异,可用蒸馏的方法获得,没有新物质生成,是物理变化,故A错误;
B.CCl4与水不互溶;而且碘在CCl4中的溶解度比在水中的大很多,所以可用CCl4作萃取剂,从碘水中萃取碘单质,没有新物质生成,是物理变化,故B错误;
C.过滤的方法是利用溶解度的不同,将溶于液体的物质与不溶于液体的固体从共存的混合物中分离,可用过滤的方法除去粗盐中的不溶性杂质,没有新物质生成,是物理变化,故C错误;
D.三氯化铁浓溶液滴入沸水中,铁离子水解生成氢氧化铁胶体和H+,反应的离子方程式为Fe3++3H2O(沸水)?Fe(OH)3(胶体)+3H+,是化学变化,故D正确;
故选D.
点评 本题考查化学变化和物理变化的区别,解答本题要分析变化过程中是否有新物质生成,如果没有新物质生成就属于物理变化,如果有新物质生成就属于化学变化,题目较简单.


科目:高中化学 来源: 题型:解答题
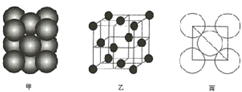 A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,C原子最外层电子数是其电子总数的$\frac{1}{3}$;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第10列.
A、B、C、D、E、F为周期表中前36号元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,C原子最外层电子数是其电子总数的$\frac{1}{3}$;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第10列.
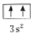 违背了泡利原理.
违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 每100g含有 营养成分 | 糖类 | 油脂 | 蛋白质 | 维生素C | 钙 | 镁 | 钠 | 锌 | 苯甲酸钠 |
| 7.6g | 7.8g | 7.4g | 18mg | 201mg | 18.2mg | 30.8mg | 8.1mg | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某蓝色溶液中加NaOH溶液,生成蓝色沉淀,说明原溶液中有Cu2+ | |
| B. | 某溶液中加BaCl2溶液,生成白色沉淀,继续滴加稀硝酸沉淀不溶解,说明原溶液中有SO42- | |
| C. | 某溶液中加硝酸银溶液,生成白色沉淀,继续滴加稀硝酸有部分沉淀不溶解,说明原溶液中一定有Cl- | |
| D. | 某溶液中加稀硫酸溶液生成无色无味气体,该气体能使澄清石灰水变浑浊,说明原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(4{×10}^{-9}+1{×10}^{-12})}{5}$ | B. | $\frac{(8{×10}^{-9}+1{×10}^{-12})}{5}$ | ||
| C. | 5×10-10 | D. | 5×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
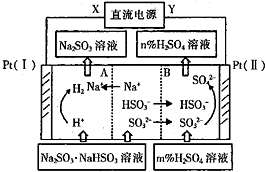
| A. | Pt(Ⅱ)为阳极 | B. | 阳极区[H+]增大 | ||
| C. | 图中的n<m | D. | 阴极电极反应式为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com