
设NA为阿伏加德罗常数的值。下列叙述错误的是( )
A.常温常压下,8.8g CO2和N2O混合气体中所含的电子数为4.4NA
B.5.6 g铁与500 mL 2 mol·L-1硝酸反应,转移的电子数为0.2NA
C.常温常压下,0.4 mol Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
D. V La mol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023
【知识点】计算A1 B3H3
【答案解析】B解析: CO2和N2O互为等电子体,二者的相对分子质量相同,因此8.8g CO2和N2O混合气体中所含的电子数为8.8×22/44=4.4mol,A正确;5.6g铁的物质的量为:0.1mol,500mL,2mol•L-1硝酸溶液中含有硝酸的物质的量为:2mol/L×0.5mol=1mol,硝酸过量,则0.1mol铁完全反应生成0.1mol铁离子,失去0.3mol电子,转移的电子数为0.3NA,B错误;0.4 mol Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.2×2×(1-0)=0.4mol,C正确;D、若Fe3+没有水解,则Cl-的数目为Fe3+的3倍,但Fe3+会水解,使其个数比Cl-的1/3少,正确。
【思路点拨】解关于阿伏加德罗常数的试题需注意:氧化还原反应中电子转移(得失)数目方面的陷阱如本题的B、C项;考查电解质溶液中微粒数目或弱电解质的电离,盐类水解方面的知识;胶粒是许多分子的集合体,如1 mol铁完全转化为氢氧化铁胶体后,胶粒数远小于NA等。


科目:高中化学 来源: 题型:
某学习小组针对如何测定镀锌铁皮镀锌层厚度提出如下一些方案:
方案1.将一定质量的镀锌铁皮投入到足量的盐酸中,使其完全溶解,通过测量氢气的体积,计算铁皮上的锌的质量。
方案2.将一定质量的镀锌铁皮(W1)投入到足量的FeSO4溶液中,一段时间后,取出铁片,洗净、烘干、称量(W2),计算铁皮上的锌的质量。
方案3.将一定质量的镀锌铁皮投入到足量的盐酸中,使其完全溶解,再在所得溶液中加入过量的NaOH溶液,过滤、洗涤、烘干、灼烧、沉淀,最后称量。
……
(1)方案2的主要特点是__________,
方案3的主要缺点是__________。
(2)方案1中用到测量气体体积的装置,如图装置中不能用于测量气体体积的装置是 。
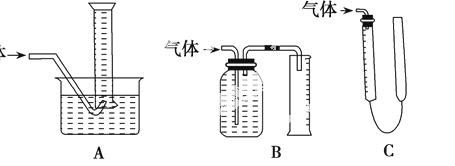
学习小组拟选用C装置作量气装置,则气体收集完毕,准备读数时,应注意:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是关于反应A2(g)+3B2(g)  2C(g)(正反应为放热反应)
2C(g)(正反应为放热反应)
的平衡移动图形,影响平衡移动的原因是
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时使用适宜的催化剂
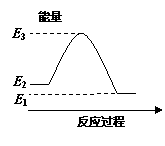 D.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时减小生成物浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列说法中正确的是
A.1L 1mol·L-1的CH3COOH溶液中含有NA个氢离子
B.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
C.0.1mol金属钠在过量氧气中充分燃烧,生成的化合物中离子总数为0.15NA
D.在VLCO和NO的混合气体中含有的氧原子个数为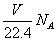
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是
.. A.0.1mol·L-1的Na2CO3溶液中,阴离子的总数目大于0.1NA
.. B.常温下,46 g NO2和N2O4混合气体中含有的分子总数为2NA
.. C.标准状况下,22.4L的HF含有NA个分子
.. D.标准状况下,10g的庚烷分子中含有2.2NA个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.常温常压下,46g NO2与N2O4的混合气体中含有的分子总数为NA
B.0.1mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA
C.25。C时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA
D.一定量的钠与8g氧气作用,若两者均无剩余,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为__________________________ ______________________________________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为________(填元素符号),其原因是__________________________________________ ______________________________。
(3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
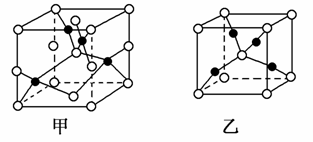
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为____________________,乙为______________________;高温时,甲易转化为乙的原因为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量的饱和石灰水完全吸收可得100gCaCO3沉淀,则完全燃烧1mol无水乙醇时放出的热量是( )
A.0.5Q B. Q C. 2Q D.5Q
查看答案和解析>>
科目:高中化学 来源: 题型:
用单位质量的溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量物质的量浓度,其单位为mol/kg,若5 mol/kg的H2SO4溶液的密度为1.30 g/mL,则它的物质的量浓度为  ( )
( )
A.3.56 mol/L B.4.36 mol/L C.5.00 mol/L D.5.25 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com