
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和 丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
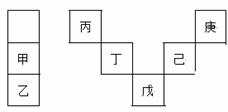 A.丙与戊的原子序数相差28
A.丙与戊的原子序数相差28
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物可用于制造光导纤维
【答案】AD
【解析】己的最高氧化物对应水化物有强脱水性为浓硫酸,则己是S元素,可以推出庚是F元素,戊是As元素,丁是Si元素,丙是B元素,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数,甲是Mg,乙是Ca。A.丙与戊的原子序数相差(8+18+2)=28,对;B.非金属性越强,气态氢化物越稳定,气态氢化物的稳定性:庚>己>戊,B错;甲单质 与水反应不剧烈,C错;丁是Si元素,二氧化硅可用于制造光导纤维,D对。
与水反应不剧烈,C错;丁是Si元素,二氧化硅可用于制造光导纤维,D对。
【考点定位】本题主要考查元素周期报和元素周期律的应用,光导纤维的主要成分。
【名师点睛】在解决有关元素周期表和元素周期律的问题时要具备一些基础知识:1、元素周期表的基本结构,多少个主族,多少个周期,每一周期有多少种元素等。2、必须记得前三周期的元素。3、前三周期元素的化合价、原子半径大小规律。4、同周期、同主族元素性质的递变规律。5、金属性、非金属性强弱的比较。6、离子半径的大小比较。


科目:高中化学 来源: 题型:
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0 (Ⅰ)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
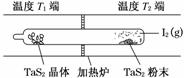
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(4)25 ℃时,H2SO3HSO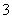 +H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中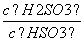 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于氧化还原反应的下列说法正确的是()
| A. | 含氧酸能起氧化作用,无氧酸则不能 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 失电子难的原子获得电子的能力一定强 | |
| D. | 由X变为X2+的反应是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断中一定正确的是( )
A.若R2+和M+的电子层结构相同,则碱性:ROH>MOH
B.若X2、Y2都是气态单质,且酸性HX>HY,则非金属性X>Y
C.若A2+2D-=2A-+D2,则还原性:D->A-
D.若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N
查看答案和解析>>
科目:高中化学 来源: 题型:
实验探究是体验知识的产生或形成过程的基本途径.下面是某同学探究实验报告的一部分,请填空:实验目的:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、四氯化碳
| 实验步骤 | 结论 |
| ①NaCl溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序: 氯、溴、碘 |
| ②KBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
(1)完成该实验需用到的仪器是______;
(2)CCl4在实验中所起的作用是______;
(3)在实验②中四氯化碳层颜色变化过程为______;
(4)该同学的实验缺陷是______,改进的办法是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.近期媒体报道的某白酒中添加的塑化剂是对人体健康无害的物质
B.尽量使用含12C的产品,减少使用含13C或14C的产品符合“低碳经济”宗旨
C.大量二氧化碳气体的排放是形成酸雨的主要原因
D.使用太阳能、风能、潮汐能等能源能减少PM2.5的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)可用 (填名称)来检验淀粉是否完全水解;可通过淀粉的水解产物与新制氢氧化铜加热反应产生砖红色沉淀来确定水解产物中含 (填分子式)。
(2)工业上生产聚乙烯的化学反 应方程式为 。
应方程式为 。
(3)乙烯使酸性高锰酸钾褪色的反应属于________反应。(填反应类型)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com