
最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
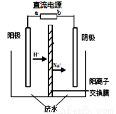
(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:① 4OH--4e-=O2↑+2H2O② 。
阴极:① 。②CH3CHO+2e-+2H2O=CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”、“减小”或“不变”)。
(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填字母序号)。
a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO 42-)+c(CH3COO-)+c(OH-)
42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)高纯度氧化铝是用于制备隔膜的材料,某研究小组用以下流程制取高纯度氧化铝:
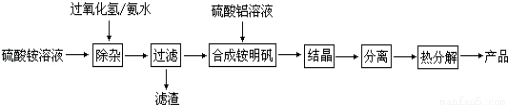
①“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
②配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
③“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学试卷(解析版) 题型:实验题
从海带中提取碘,有甲、乙两种实验方案如下:
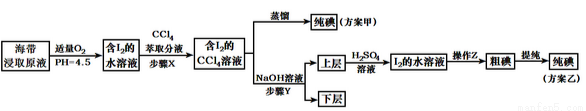
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。请回答:
(1)步骤X使用分液漏斗前须检漏,检漏方法为_________。
(2)用右图所示装置进行蒸馏。指出右图所示实验装置中的任意两处错误:
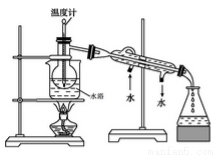
①___________;②__________。
(3)进行上述操作时,使用水浴加热更好的原因是___________;最后碘晶体在__________里聚集。
(4)下列有关步骤Y的说法,正确的是________。
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
(5)方案乙在上层溶液中加入H2SO4溶液得到I2的水溶液发生的反应方程式是:_____________;
(6)操作Z的名称是____________。
(7)工业中采用方案乙从海带中提取碘,方案甲中采用蒸馏不合理,理由是______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
pH相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B ④反应
过程的平均速率B>A ⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余
A.③④⑥ B.②③⑥ C.③④⑤ D.①②⑤
查看答案和解析>>
科目:高中化学 来源:2017届安徽师大附中高三上新课标模拟化学卷(解析版) 题型:推断题
【化学——选修3:物质结构与性质】周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为:_______________________。
(2)YX4-的空间构型是:_________,HYX4酸性比HYX2强,其原因是:_______________。
(3)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为:________________ (H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是:____________。A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道进
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如下图所示 (黑点代表Z原子)。

①该晶体的化学式为____________。
②已知该晶体的密度为ρg·cm-3,阿伏加徳罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为___________㎝(只写计算式)(Z原子位于体对角线上)。
查看答案和解析>>
科目:高中化学 来源:2017届安徽师大附中高三上新课标模拟化学卷(解析版) 题型:选择题
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
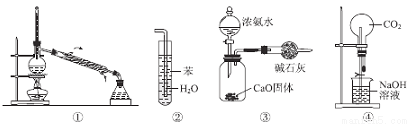
A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收氨气,且能够防止倒吸
C.装置③可用于制备少量NH3
D.装置④无法形成喷泉
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
下列有关电解质溶液的说法正确的是
A.向0.1mol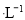 CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中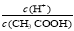 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中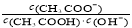 增大
增大
C.向盐酸中加入氨水至中性,溶液中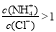
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中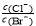 不变
不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
H2C2O4为二元弱酸。20℃配制一组c(H2C2O4)+c(HC2O4–)+c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。一定正确的是
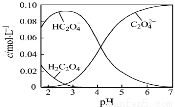
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC 2O4–)
2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考三化学试卷(解析版) 题型:填空题
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)煤化工通常通过研究不同温度下的平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:
CO(g)+H2O(g) H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
①若在500℃时进行反应,设CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为 。
②800℃时,在固定容积的密闭容器中放入混合物,起始浓度为:c(CO) =0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L, c(H2)=0.05mol/L ,则
=0.01mol/L,c(H2O)=0.03mol/L,c(CO2)=0.01mol/L, c(H2)=0.05mol/L ,则 反应开始时,H2的消耗速率比生成速率 (填“大”、“小”或“不能确定”)。
反应开始时,H2的消耗速率比生成速率 (填“大”、“小”或“不能确定”)。
(2)2SO2(g)+O2(g) 2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2
2SO3(g)反应过程中的能量变化如图所示:又已知1molSO2 (g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
(g)氧化为1molSO3(g)的ΔH=-99 kJ·mol-1,请回答问题:
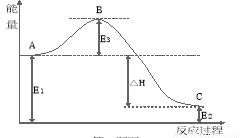
该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”或“降低” )△H (填“变大”、“变小”或“不变”);
(3)已知某反应的平衡常数表达式为: ,它所对应反应的化学方程式为
,它所对应反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省高二上期中文化学试卷(解析版) 题型:填空题
(1).脂肪、淀粉、 蛋白质是三种重要的营养成分,其中____________不属于高分子化合物,但它们都能发生__________反应。
蛋白质是三种重要的营养成分,其中____________不属于高分子化合物,但它们都能发生__________反应。
(2)食物的酸碱性和溶液的酸碱性___________(填“相同”或者“不同”);含 有碳、氮、硫、磷等非金属元素的蛋白质,在人体内经过消化、吸收后,最终代谢成__________物质(填“酸性”或者“碱性”),因此,富含蛋白质的食物属于____________食物(填“酸性”或者“碱性”)。
有碳、氮、硫、磷等非金属元素的蛋白质,在人体内经过消化、吸收后,最终代谢成__________物质(填“酸性”或者“碱性”),因此,富含蛋白质的食物属于____________食物(填“酸性”或者“碱性”)。
(3)药品 标签上都贴有OTC或R标记。平时我们到药店能自己买到的药如阿司匹林应贴有 标记(填“OTC”或者“R”)。
标签上都贴有OTC或R标记。平时我们到药店能自己买到的药如阿司匹林应贴有 标记(填“OTC”或者“R”)。
(4)使用刀具时不小心割破了手指,在家庭小药箱里有风油精、速效感冒胶囊、板蓝根冲剂、胃舒平、碘酒等,可用于处理伤口的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com