
【题目】![]() 溶液与
溶液与![]() 溶液发生反应:
溶液发生反应:![]() ,达到平衡。下列说法不正确的是( )
,达到平衡。下列说法不正确的是( )
A. 加入苯,振荡,平衡正向移动
B. 经苯2次萃取分离后,在水溶液中加入![]() ,溶液呈血红色,表明该化学反应存在限度
,溶液呈血红色,表明该化学反应存在限度
C. 加入![]() 固体,平衡逆向移动
固体,平衡逆向移动
D. 该反应的平衡常数![]()
科目:高中化学 来源: 题型:
【题目】有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层p能级上有两个未成对电子且无空轨道;Y原子的价电子排布为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是
A.元素Y和Q可形成化合物Y2Q3
B.X与T的最高价氧化物对应的水化物,前者的酸性比后者强
C.X和Q结合生成的化合物为离子化合物
D.ZQ2是极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置及药品能实现相应实验目的的是
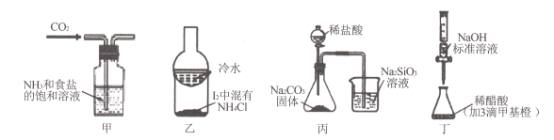
A. 甲用于制取NaHCO3晶体 B. 乙用于分离I2和NH4Cl
C. 丙用于证明非金属性强弱:Cl>C>Si D. 丁用于测定某稀醋酸的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________________________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为______。
(4)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K______1.0(填“大于”“小于”或“等于”)。
(5)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____移动(填“向正反应方向”“向逆反应方向”或“不”)。
(6)若1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为__________(填“正反应方向”“逆反应方向”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为![]() 价,Y元素与Z、M元素相邻,且与M元素同主族;化合物
价,Y元素与Z、M元素相邻,且与M元素同主族;化合物![]() 的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法不正确的是( )
的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法不正确的是( )
A. 原子半径:![]()
B. 最高价氧化物对应水化物的酸性:![]()
C. ![]() 易溶于水,其水溶液呈碱性
易溶于水,其水溶液呈碱性
D. X、Z和Q三种元素形成的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
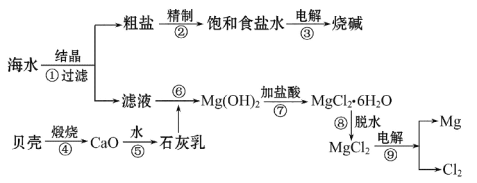
(1)上述流程图①~⑨步骤中,属于氧化还原反应的是__________(填序号);
(2)若粗盐中仅含有Ca2+、Mg2+两种杂质离子。精制提纯时,备用的除杂试剂有:(A.盐酸、B.Na2CO3溶液、C.NaOH溶液)。请你正确排列加入的顺序:__________(填编号);

(3)用如图电解饱和食盐水,石墨棒上产生的气体为Cl2;在铁棒周围的溶液里滴加紫色石蕊试液,溶液变成_____________色;
(4)在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作依次为__________(填编号)。
A.蒸馏 B.蒸发 C.冷却结晶 D.晶体灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带具有从海水中富集碘的能力,下面是从海带中提取碘单质的流程:

(1)步骤c的操作方法是__________;除漏斗、烧杯外,还需要使用的玻璃仪器是_________。
(2)步骤d所得溶液的颜色为_______,反应的离子方程式为_______________________________。
(3)步骤e中加入CCl4振荡、静置后,液体分为两层,上层液体呈_____色,下层液体呈______色;步骤e的操作方法是_____________,所用的主要实验仪器是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图有机物的正确命名为 ( )

A.2-乙基-3,3-二甲基戊烷B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷D.3,4,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用Cl2氧化K2MnO4制备KMnO4的装置如下图所示(夹持装置略):
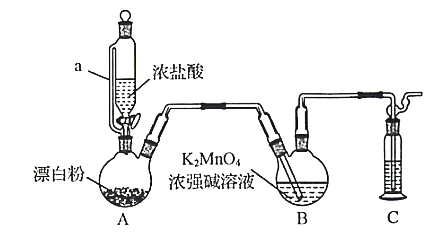
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
![]()
回答下列问题:
(1)装置A中a的作用是______________;装置C中的试剂为________________;装置A中制备Cl2的化学方程为______________。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是________________。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入___________(填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若KMnO4溶液起始读数为15.00mL,此时滴定管中KMnO4溶液的实际体积为______________(填标号)。
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
(4)某FeC2O4﹒2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4﹒2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含![]() 的质量分数表达式为_________________。
的质量分数表达式为_________________。
下列关于样品组成分析的说法,正确的是__________(填标号)。
A.![]() 时,样品中一定不含杂质
时,样品中一定不含杂质
B.![]() 越大,样品中
越大,样品中![]() 含量一定越高
含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com