
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应式为:
3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述正确的是
A.放电时,正极区溶液的pH减小
B.放电时,负极反应式为3Zn-6e-+6OH-=3Zn(OH)2
C.充电时,每转移3 mol电子,阳极有1 mol Fe(OH)3被还原
D.充电时,电池的锌电极接电源的正极
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.一定条件下可以用H2除去乙烷中混有的乙烯
B.苯和四氯化碳都能萃取溴水中的溴
C.乙醇、乙酸和乙酸乙酯三者的混合液可用分液的方法分离
D.甲烷、乙烯和苯在工业上都可通过石油分馏得到
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4LCCl4含有的分子数为NA
B.常温常压下,17gNH3 所含的原子数目为4NA
C.1 mol Na2O2与H2O完全反应,转移2NA个电子
D.0.1mol/LNa2CO3溶液中含有的Na+数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
两个化学兴趣小组进行了以下探究活动:
第一组:为研究铁质材料与热浓硫酸的反应,
(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中是否含有Fe2+,应选择加入的试剂为 (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。据此推知气体Y 中SO2的体积分数为 。
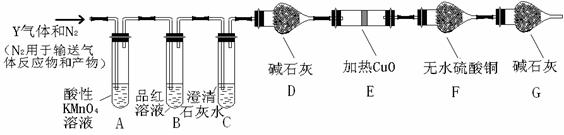 分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(2)写出产生CO2的化学方程式 。
(3)装置A中试剂的作用是 ,反应的离子方程式 。
(4)简述确认气体Y中含有CO2的实验现象 。
(5)如果气体Y中含有H2,预计实验现象应是 。
第二组:拟用下列装置定量分析空气中SO2的含量:
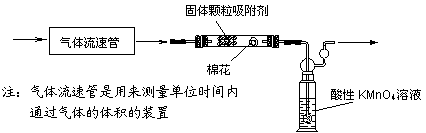
(6)KMnO4溶液中导管末端做成球状多孔结构的作用是
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为 g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质与应用对应关系正确的是
A.氨气具有碱性,可用作制冷剂
B.二氧化硅能与氢氟酸反应,可用于生产光导纤维
C.铝具有良好导电性和耐腐蚀性,可用于制作高压输电线
D.二氧化铅具有强氧化性,可用于铅蓄电池的负极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,H2S的电离常数Ka1、Ka2满足 Ka1·Ka2=3×10-22,H2S饱和溶液物质的量浓度约为0.10mol·L-1;Ksp(CuS)=6×10-36,Ksp(MnS)=4.5×10-14。下列说法正确的是
A.相同温度下,CuS在水中的溶解度比MnS小
B.CuS和MnS一定都溶于强酸
C.反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+ K=7.5×1021
D.在浓度均为0.01mol·L-1Cu2+和Mn2+混合溶液中,通入H2S只有MnS沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
自从1985年发现了富勒烯以来,由于其具有独特的物理和化学性质,越来越受到人
们的关注。
(1)富勒烯(C60)在液相中用FeCl3催化可生成二聚体,过程见图21A—1。
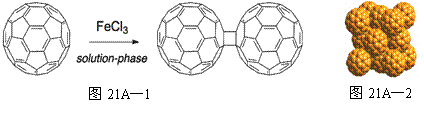 |
①Fe3+基态时核外电子排布式为 ;
②1molC60分子中含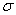 键数目为 ;
键数目为 ;
③富勒烯二聚体中碳原子杂化轨道类型有 。
(2)C60的晶胞结构如图21A—2,则与每个C60分子紧邻的C60分子有 个。
(3)我国科学家发现杯[8]芳烃(如图21A—3所示)能与C60形成包合物(如图21A—4),
①杯[8]芳烃底部8个羟基间的作用为 ;
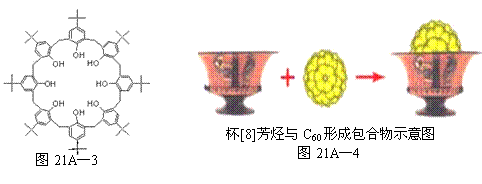 ②杯[8]芳烃包合物中C60与杯芳烃间的作用力为 。
②杯[8]芳烃包合物中C60与杯芳烃间的作用力为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
| 溶液组成主要成分 | 对应图像 | 溶液中离子浓度关系 | |
| A | Na2CO3、NaHCO3 | Ⅰ | c(Na+)=c(HCO |
| B | NaHCO3、Na2CO3 | Ⅱ | c(CO |
| C | NaOH、Na2CO3 | Ⅲ | c(OH-)>c(CO |
| D | Na2CO3 | Ⅳ | c(Na+)=c(CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
23.铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。
24.镓(Ga)与铝同族。写出镓的氯化物和氨水反应的化学方程式。
25.硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 。
长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为
26.用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO 3Ba↑+BaO·Al2O3
3Ba↑+BaO·Al2O3
常温下Al的金属性比Ba的金属性 (选填“强”“弱”)。利用上述方法可制取Ba的主要原因是 。
a.高温时Al的活泼性大于Ba b.高温有利于BaO分解
c.高温时BaO·Al2O3比Al2O3稳定 d.Ba的沸点比Al的低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com