
有关水的电离平衡的说法正确的是( )
A.水的离子积通常用KW来表示,随温度变化而变化,只适用于纯水,在稀盐酸中数值会变大
B.在纯水中加入硫酸会抑制水的电离,加醋酸会促进水的电离
C.盐溶于水对水的电离平衡均没有影响
D.在纯水中加入氢氧化铁固体对水的电离平衡会有微弱的影响
科目:高中化学 来源:2014年高考化学苏教版总复习 9-2 食品中的有机化合物练习卷(解析版) 题型:选择题
下列关于有机物的正确说法是( )
A.聚乙烯可发生加成反应
B.石油干馏可得到汽油、煤油等
C.淀粉、蛋白质完全水解的产物互为同分异构体
D.乙酸乙酯、油脂与NaOH溶液反应均有醇生成
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
为了使FeCl3溶液中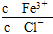 增大,可加入的物质是( )
增大,可加入的物质是( )
A.适量的HCl气体 B.适量的硫酸氢钠
C.适量的NaOH固体 D.适量的NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:选择题
常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是 ( )
A.该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
B.pH=3的HA与pH=11的NaOH溶液等体积混合后:c(Na+)>c(A-)>c(OH-)>c(H+)
C.物质的量浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L-1HA溶液与0.05 mol·L-1NaOH溶液等体积混合后所得溶液中2c(H+)+c(HA)=c(A-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:填空题
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
CaSO4 | 7×10-5 |
CaCO3 | 5×10-9 |
请回答下面问题:
(1)表1所给的四种酸中,酸性最弱的是________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________(填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”或“碱性”),理由是_______________,溶液中各离子浓度大小关系是______。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为______________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42—物质的量浓度不小于0.01 mol·L-1,则溶液中CO32—物质的量浓度应≥________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:选择题
NaHA是二元酸H2A的酸式盐,下列说法不正确的是( )
A.若NaHA溶液呈酸性,则H2A一定是强酸
B.若NaHA溶液呈碱性,则H2A一定是弱酸
C.NaHA溶液中Na+和HA-的个数之比一定大于1∶1
D.NaHA晶体中的阴阳离子个数比一定是1∶1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:填空题
500℃时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,分析图像完成下列问题:
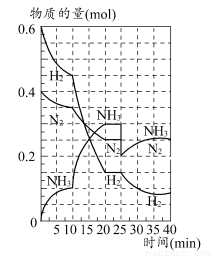
(1)0~10分钟,N2的平均反应速率为________mol·L-1·min-1,0~10分钟与10~20分钟两个时间段中,N2的反应速率之比为________。反应在第10 min可能改变的条件是________,运用图像信息说明该条件不是升温的原因:________。
(2)计算500℃时,反应N2+3H2 2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
(3)在上图中画出25~40 min时间段内N2的物质的量的变化图像。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:填空题
300°C时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300°C时,该反应的平衡常数表达式为K=________。已知K300°C<K350°C,则ΔH________0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为_______,D的平均反应速率为_______。
(3)若温度不变,缩小容器容积,则A的转化率________(填“增大”“减小”或“不变”),原因是__________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时若加入C、D各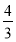 mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B________mol。
mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B________mol。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:选择题
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
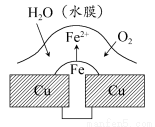
A.此过程中铜并不被腐蚀
B.此过程中电子从Fe移向Cu
C.正极反应式为:2H++2e-=H2↑
D.此过程中还涉及反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com