
| A. | 三者对应的氧化物均能溶于水 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
分析 A.依据氧化铝、氧化铜、氧化铜水溶性解答;
B.根据Al、Fe、Cu三者放在空气中所发生的反应来回答;
C.氯化铝、氯化铁和氯化铜都是强酸弱碱盐易水解;
D.根据电解原理,阴极上析出的金属应按照其对应的阳离子的放电顺序来析出;
解答 解:A.氧化铝、氧化铜、氧化铜都不溶于水,故A错误;
B.Fe还可以形成复杂的氢氧化物,Cu可以形成碱式碳酸铜等,故B错误;
C.因为AlCl3、FeCl3、CuCl2的溶液加热时都水解生成沉淀和HCl气体了,HCl挥发了,所以得到的是各自的沉淀物,制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法,故C正确;
D.根据电解原理,阴极上离子的放电顺序是:Cu2+>H+>Fe2+>Al3+,Fe2+和Al3+不放电,Fe3+得电子成为Fe2+,不会析出铁,所以铁和Al不可以析出,因为它们比H活泼,只有Cu可以,故D错误;
故选:C.
点评 本题考查 了金属及其化合物的性质,熟悉常见的金属单质的性质、电解原理以及盐类水解的应用是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
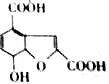
| A. | M的分子式为C18H8O8 | |
| B. | 1molM最多可与3molNa反应 | |
| C. | 一个M分子中含有一个苯环和两个羧基 | |
| D. | M可发生酯化反应,氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离苯和乙酸的混合物 | 分液漏斗、烧杯 | |
| B | 鉴别葡萄糖和乙酸甲酯 | 试管、烧杯、酒精灯 | 葡萄糖溶液、乙酸甲酯溶液、银氨溶液 |
| C | 实验室制取CO2 | 试管、带导管的橡胶塞 | 大理石、稀硫酸 |
| D | 测定未知NaOH溶液浓度 | 酸、碱式滴定管、锥形瓶、烧杯 | NaOH溶液、0.1mol/L盐酸标准液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 现象 |
| Ⅰ | 向2 mL 0.1 mol/LFeCl2溶液中滴加KSCN溶液,再滴加氯水 | |
| Ⅱ | 向2 mL 0.1 mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol/L KI溶液 | 滴加KSCN溶液后,溶液变成红色; 滴加KI溶液后,红色无明显变化 |
| 编号 | 操作 | 现象 |
| Ⅲ | 向2 mL 0.1 mol/L KI溶液中滴加1 mL 0.1 mol/L FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色; 滴加KSCN溶液后,溶液变成红色 |
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2 mL 0.1 mol/L KI溶液中滴加 1 mL 0.1mol/L FeCl3溶液,或CCl4;或铁氰化钾溶液 | 溶液变蓝(或溶液分层,下层溶液为紫色;或生成蓝色沉淀),结论:Fe3+能与I-发生氧化还原反应,生成I2(或Fe2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(H+)>c(OH-),且Kw=c(H+).c(OH-)=1×10-14mol2/L2 | |
| B. | 由水电离出来的H+浓度为1×10-14mol/L-1 | |
| C. | 溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 此溶液中由水电离出来的c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com