
| A、CO32-+H2O?HCO3-+OH-用热的纯碱溶液清洗油污 |
| B、Al3++3H2O?Al(OH)3+3H+明矾净水 |
| C、TiCl4+(x+2)H2O(过量)═TiO2?xH2O↓+4HCl 制备TiO2纳米粉 |
| D、SnCl2+H2O═Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通入氧气的电极为正极 |
| B、参加反应的O2与C2H6的物质的量之比为7:2 |
| C、放电一段时间后,KOH的物质的量浓度将下降 |
| D、放电一段时间后,正极区附近溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有I-,不含有Cl- |
| B、可能含有Cl-、NO3-和I- |
| C、可能含有NO3- |
| D、一定不含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:A<B<C |
| B、A的氢化物稳定性大于C的氢化物稳定性 |
| C、三种元素的最高价氧化物对应水化物均可由化合反应得到 |
| D、高温下,A单质能置换出C单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气通入醋酸溶液中:NH3+H+=NH4+ | ||||
B、用铜片作阴、阳极电解硝酸银溶液:4Ag++2H2O
| ||||
| C、碳酸氢钡溶液中加入过量氢氧化钠溶液:Ba2++HCO3-═BaCO3↓+H2O | ||||
| D、AgCl沉淀在氨水中溶解:AgCl+2NH3?H2O══[Ag(NH3)2]++Cl-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浊液a中存在沉淀溶解平衡:Mg(OH)2(s)═Mg2+(aq)+2OH-(aq) |
| B、滤液b中不含有Mg2+ |
| C、②中颜色变化说明Mg(OH)2转化为Fe(OH)3 |
| D、实验可以证明Fe(OH)3比Mg(OH)2更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A、放出热量关系:a=92.4<b |
| B、N2的转化率:③>①>② |
| C、达平衡时氨气的体积分数:①>③ |
| D、三个容器内反应的平衡常数:③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “钠-硫”原电池具有输出功率较高.循环寿命长等优点,其工作原理可表示为:2Na+xS
“钠-硫”原电池具有输出功率较高.循环寿命长等优点,其工作原理可表示为:2Na+xS| 放电 |
| 充电 |
| A、这是一种新型无机非金属材料 |
| B、此化合物可能发生加成反应 |
C、原电池的负极反应将是单体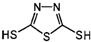 转化为 转化为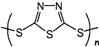 的过程 的过程 |
| D、当电路中转移0.02 mol电子时,将消耗原电池的正极反应材料1.48 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com