
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是

A. 该温度下,HClO![]() H++ClO-的电离常数Ka的对值lgKa= -7.54
H++ClO-的电离常数Ka的对值lgKa= -7.54
B. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
C. pH=1的氯水中,c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-)
D. 已知常温下反应Cl2(aq)+Cl-(aq)![]() Cl3-(aq)的K=0.191,当pH增大时,K减小
Cl3-(aq)的K=0.191,当pH增大时,K减小
【答案】D
【解析】
A. 根据图像,pH=7.54时c(HClO)=c(ClO-),由电离方程式HClO![]() ClO-+H+可知, Ka=
ClO-+H+可知, Ka=![]() =c(H+)由此分析解答;
=c(H+)由此分析解答;
B.从氯水中含有的Cl2、ClO-、HClO均具有氧化性,KI具有还原性分析;
C.根据pH=1时溶液中各种微粒的物质的量分数分布分析;
D.根据化学平衡常数只与温度有关分析。
A. 根据图像,pH=7.54时c(HClO)=c(ClO-),由电离方程式HClO![]() ClO-+H+可知,Ka=
ClO-+H+可知,Ka=![]() =c(H+)=10-7.54,则lgKa=-7.54,A正确;
=c(H+)=10-7.54,则lgKa=-7.54,A正确;
B.氯水中含有的Cl2、ClO-、HClO均具有氧化性,KI具有还原性,Cl2、ClO-、HClO三种微粒都可以与KI发生氧化还原反应,B正确;
C.根据图像,pH=1时氯水中各种含氯微粒的物质的量分数由多到少的顺序是:Cl->Cl2>Cl3->HClO>ClO-,由于溶液为同一溶液,溶液的体积相同,所以溶液中微粒的浓度大小关系为:c(Cl2)>c(Cl3-)>c(HClO)>c(ClO-),C正确;
D.已知常温下反应Cl2(aq)+Cl-(aq) ![]() Cl3-(aq)的K=0.191,K只与温度有关,温度不变,pH增大时,K不变,D错误;
Cl3-(aq)的K=0.191,K只与温度有关,温度不变,pH增大时,K不变,D错误;
故合理选项是D。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】随着现代工业的发展,二氧化碳污染的处理成为科学研究的重点,回答下列问题:
I.有人提出利用H2还原CO2使其转化为有机化工的主要原料乙烯。
(1)查阅资料:H2的燃烧热为285.8kJ/mol,C2H4的燃烧热为l41lkJ/mol,lmolH2O(1)转化为H2O(g)需吸收44kJ的热量。则反应6H2(g)+2CO2(g) ![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
△H=___________kJ/mol。
(2)下图是探究不同温度对CO2的转化率和催化剂的催化效率影响的示意图。

①生产中通常选用的温度最好是___________,理由是___________。
②图中表示的化学平衡常数:M___________N(填>、=、<)
③250℃时,在2L密闭容器中分别充入6molH2和2 molCO2,到达平衡时体系中C2H4的体积分数为___________。
Ⅱ.CO在一定条件下,能与H2合成二甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)。
CH3OCH3(g)+3H2O(g)。
(1)在1L的密闭容器中分别充入2.5molH2与 bmol CO2发生反应,在不同温度下达到平衡状态时测得实验数据如下表:

①到达平衡时若升高温度,则上述平衡___________方向移动(填“正反应”或“逆反应”)。
②转化率:x___________y(填>、=、<)
(2)新型高效的二甲醚燃料电池工作时总反应式:CH3OCH3+3O2=2CO2+3H2O。
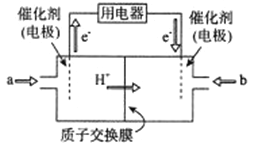
①该电池的负极是___________(填a或b),负极电极反应式为___________;
②利用该电池冶铝,若制得金属铝54g理论上消耗二甲醚___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间
浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
(Ⅰ)无催化剂、不加热 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 |
(Ⅱ)无催化剂、加热 | 360 | 480 | 540 | 720 |
(Ⅲ)MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
该小组在设计方案时,考虑了浓度、a:___________b:___________等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:_____________。
(2)将质量相同但颗粒大小不同的MnO2分别加入到5 mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂 (MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生反应的化学方程式:______________________。
②实验结果说明催化剂作用的大小与________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.甲烷和苯都可以和氯气在一定条件下发生取代反应
B.乙烯、乙炔、苯都能使溴水褪色,其褪色原理相同,都发生加成反应
C.![]() 的名称是2,
的名称是2,![]() 二甲基戊烷
二甲基戊烷
D.乙烯、溴苯分子中的所有原子都处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。

①下列能说明该反应达到平衡的是___________。
A.CO和CO2的浓度之比为1∶1
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,T℃时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种说法中错误的是:
①化学反应除了生成新物质外,还伴随着能量的变化;②同温同压下,H2 (g)+Cl2 (g)==2HCl(g)在光照和点燃条件下的反应热ΔH不同;③为防治酸雨、降低工业废气,常用生石灰进行“钙基固硫”:CaO+SO2= CaSO3、2CaSO3+O2![]() 2CaSO3;④开发太阳能、风能、地热能、潮汐能等新能源,可减少雾霾、保护环境;⑤煤的气化和液化技术,可高效、清洁地利用煤;⑥从海水提镁的过程为:MgCl2(aq)
2CaSO3;④开发太阳能、风能、地热能、潮汐能等新能源,可减少雾霾、保护环境;⑤煤的气化和液化技术,可高效、清洁地利用煤;⑥从海水提镁的过程为:MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
A. ①③④ B. ②⑥ C. ①④⑤ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定实验。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃玻璃棒、50 mL0.25 mol· L-1稀硫酸、50 mL 0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是:__________________、__________________。
(2)某同学用该装置做实验,因有些操作不规范,造成所测中和热的数值偏低,请分析可能的原因是_________________(用标号字母填写)。
A.测量稀硫酸温度后,温度计没用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C. 量取稀硫酸时仰视计数
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.大烧杯的盖板中间小孔太大了
(3)实验得到表中的数据:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
假设0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都近似取1g/cm3,中和后所得溶液的比热容c =4.18 J/(g·℃)。则中和热ΔH =_____________ kJ/mol。
(4)如果用60mL0.25mol/L硫酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填:“增多”、“不变”、“减少”),所求中和热_________(填:“相等”、“不相等”)。
(5)若用KOH代替NaOH,对测定结果_______________(填:“有” 或 “无”)影响。![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图形象地表示了氯化钠的形成过程,下列相关叙述中,不正确的是( )
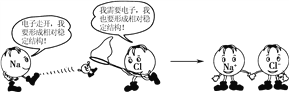
A. 钠原子易失去一个电子,氯原子易得到一个电子
B. 钠离子与钠原子有相似的化学性质
C. 钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D. 氯化钠是离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com