
����Ŀ����Ԫ������Ȼ������Ҫ��������������Ҫ�ɷ�ΪAl2O3��������Fe2O3��FeO��SiO2���С���ҵ�����������Ʊ�����ij�ֻ�����Ĺ����������¡�
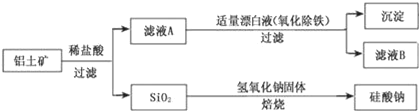
��1������ҺA�м���Ư��Һ��Ŀ��������������������ҺB�����ԡ�
�ٸù������漰ij������ԭ��Ӧ���£�����ɣ�__Fe2+___ClO��+�� ��___=____Fe��OH��3��+__C1��+�� ����
�ڼ�����ҺB���Ƿ�����Ԫ�صķ���Ϊ��________��ע���Լ�������
�۽���ҺB�е���Ԫ���Գ�����ʽ��������ѡ�õ�����Լ�Ϊ___������ţ���
a������������Һ b��������Һ c����ˮ d��������̼
������ҺB�Ʊ��Ȼ��������漰�IJ���Ϊ���ߵμ�Ũ���������Ũ������ȴ�ᾧ��____����������ƣ���ϴ�ӡ�
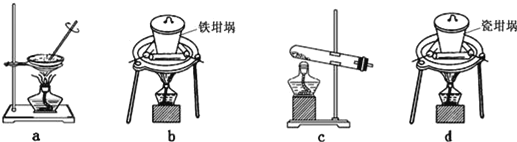
��2��SiO2��NaOH�����Ʊ������ƣ��ɲ��õ�װ��Ϊ___������ţ���
���𰸡�2��1��5��H2O��1��4��H+ ȡ������ҺB������KSCN��Һ��������죬�ټ�����ˮ����Ȼ����죬˵����ҺB�в�����Ԫ�� c ���� b
��������
��1���������̷�������Һ�к����Ȼ������Ȼ��������Ȼ���������ҺA�м���Ư��Һ��Ŀ��������������������ҺB�����ԣ�����������Ӿ���������������������Ϊ����������Һ���γ���������������ȥ������������ԭ��Ӧ�����غ��ԭ���غ���ƽ�����ݳ������ӵļ��鷽���������
��2������ʵ��Ŀ�ļ��������ʷ���ѡ��ʵ��������
��1������Һ�к����Ȼ������Ȼ��������Ȼ���������ҺA�м���Ư��Һ��Ŀ��������������������ҺB�����ԣ�����������Ӿ���������������������Ϊ����������Һ���γ���������������ȥ���������ӱ�����Ϊ����������Һ���γ�������������������������ӱ���ԭΪ�����ӣ���Ӧ�����ӷ���ʽΪ��2Fe2++ClO-+5H2O=2Fe��OH��3��+C1-+4H+���ʴ�Ϊ��2��1��5��H2O��1��4��H+��
����ҺB���Ƿ�����Ԫ�صķ���Ϊ���������ӵļ��鷽�����м��飬ȡ������ҺB������KSCN��Һ��������죬�ټ�����ˮ����Ȼ����죬˵����ҺB�в�����Ԫ�أ��ʴ�Ϊ��ȡ������ҺB������KSCN��Һ��������죬�ټ�����ˮ����Ȼ����죬˵����ҺB�в�����Ԫ�أ�
����Һ�к��е����Ȼ�����Һ������ҺB�е���Ԫ���Գ�����ʽ������
a������������Һ���Գ��������ӵ��������ܽ�������������a������ã�
b��������Һ���ܳ��������ӣ���b�����ϣ�
c����ˮ��������ܽ����������������İ�ˮ���������γ����������������˵õ������������壬��c���ϣ�
d��������̼���Ȼ�������Ӧ������������������������d�����ϣ��ʴ�Ϊ��c��
�ܼ���Ũ���������Ȼ�����ˮ�⣬����Ũ����ȴ�ᾧ�����ˣ�ϴ�ӣ��ʴ�Ϊ�����ˣ�
��2��a�������������ڹ��壬��a�����ϣ�
b���������������ڶ���������������ƣ���b���ϣ�
c�������к�����������������Ʒ�Ӧ����c�����ϣ�
d�����������ж���������������Ʒ�Ӧ����d�����ϣ��ʴ�Ϊ��b��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ��ʾ�����ӵ�������ֵ������˵���������( )
��ʾ�����ӵ�������ֵ������˵���������( )
A.56g����������������ȫȼ�գ�ת�Ƶĵ�����С��![]()
B.��![]() ��Ӧ�У�����212g�������ɣ���Ӧ�е���ת�Ƶ���ĿΪ
��Ӧ�У�����212g�������ɣ���Ӧ�е���ת�Ƶ���ĿΪ![]()
C.![]() ��
��![]() �Ļ����������������Ϊ
�Ļ����������������Ϊ![]()
D.�����£�![]()
![]()
![]() ��Һ��
��Һ��![]() ������Һ��
������Һ��![]() ��
��![]() ����Ŀ��Ϊ
����Ŀ��Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�����ṹ��ʽ��ͼ�����ڸ��л��������������ȷ����( )
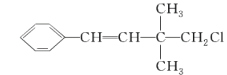
A.�����ʷ����к�����ԭ�ӣ�����������
B.1 mol ���л�������������Ȼ�̼��Һ�����ӳɷ�Ӧ��Ӧ������ 1 mol Br2
C.�������뱽��Ϊͬϵ��
D.��������һ�������£��ܷ����Ӿ۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������ͼ��ʾװ���Ʊ�����������ʵ�����£�
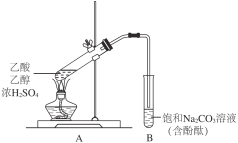
����2 mLŨH2SO4��2 mL�Ҵ����Һ�е���2 mL��������Թ�A��
��һ��ʱ����Թ�B�к�ɫ��Һ�Ϸ�������״Һ�壻
��ֹͣ���ȣ����Թ�B����״Һ���䱡���²��ɫ��Һ��ɫ��
(1)Ϊ�˼ӿ�������Ӧ���ʣ���ͬѧ��ȡ�Ĵ�ʩ��_____________��
(2)����������ת���ʣ����ɲ�ȡ�Ĵ�ʩ��_______________��
(3)�Թ�B����Һ�Ժ�ɫ��ԭ����___________�������ӷ���ʽ��ʾ����
(4)������״Һ��ijɷ���__________��
(5)���к�ɫ��ȥ��ԭ�����Ƿ�̪�������������С�֤�����Ʋ��ʵ�鷽����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�����ۼס��ҡ���������������װ�õ��й��÷������в���������

A.��װ�ã�������֤��̼�ķǽ����Աȹ�ǿ
B.��װ�ã���Ƥ�ܵ���������ʹˮ˳������
C.��װ�ã���ͼʾ�ķ������ܼ���װ�õ�������
D.��װ�ã��ȴ����ڽ�������������̼���ٴ����ڽ��������ռ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A. CS2Ϊ�ռ乹��ΪV�εļ��Է���
B. ˫ԭ�ӻ��ԭ���γɵ����嵥���У�һ��������������������
C. ��ԭ�ӵ����Ƶ�һ��С�ڵ��ʾһ������
D. SiF4��SO32-������ԭ�Ӿ�Ϊsp3�ӻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ�������������ı仯��ij��ѧ��Ӧ���������仯��ͼ��ʾ���û�ѧ��Ӧ������

A.NaOH+HCl=NaCl+H2O
B.Fe+H2SO4=FeSO4+H2��
C.2Na2O2+2H2O=4NaOH+O2��
D.Ba(OH)2��8H2O+2NH4Cl=BaCl2+2NH3��+10H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ���Ϊ��������Դ�Ȼ�ʯ��Դ���нϴ�����ƣ���ͼΪ�Ҵ�ȼ�ϵ�أ��õ�ص��ܷ�Ӧ����ʽΪC2H5OH+3O2=2CO2+3H2O�����й��ڸõ�������������
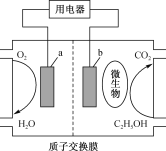
A.a�����õ������������B.��װ�ý���ѧ��ת��Ϊ����
C.����(H+)��װ��������Ҳ��ƶ�D.��װ�õĵ������Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����϶������Dzⶨ�������е������ľ��䷽������ԭ������Ũ�����ڴ��������½���Ʒ���л���ת������Σ�������ͼ��ʾװ�ô�����Σ�Ȼ��ͨ���ζ���������֪��NH3+H3BO3=NH3��H3BO3��NH3��H3BO3+HCl= NH4Cl+ H3BO3��

�ش��������⣺
��1��a��������_______________��
��2��b�з����������Ƭ��Ŀ����____________��f��������__________________��
��3����ϴ������g�м�����ˮ����k1���ر�k2��k3������b������������·��ֹͣ���ȣ��ر�k1��g ������ˮ��������c��ԭ����____________����k2�ŵ�ˮ���ظ�����2~3�Ρ�
��4��������ϴ��g�м������ᣨH3BO3����ָʾ�������������dע��e�����ע������������Һ��������ˮ��ϴd���ر�k3��d�б�������ˮ����k1������b��ʹˮ��������e��
��d�б�������ˮ��Ŀ����___________________��
��e����Ҫ��Ӧ�����ӷ���ʽΪ________________��e�����п�˫�㲣��ƿ��������________��
��5��ȡij�ʰ��ᣨC2H5NO2����Ʒm �˽��вⶨ���ζ�g������Һʱ����Ũ��Ϊc mol��L�C1������V mL������Ʒ�е�����������Ϊ_________%����Ʒ�Ĵ�����_______%��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com