
| A、c(HCO3-)>c(CN- )>c(OH- ) |
| B、c(CN- )>c(HCO3-)>c(H+ ) |
| C、c(HCN)+c(CN- )=c(HCO3-)+c(H2CO3) |
| D、c(Na+ )+c(H+ )=c(HCO3- )+c(CN- )+C(OH- ) |


科目:高中化学 来源: 题型:
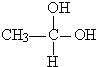 →CH3-CHO+H2O
→CH3-CHO+H2O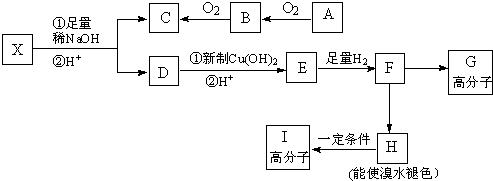
查看答案和解析>>
科目:高中化学 来源: 题型:
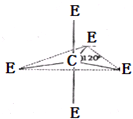 已知:A、B、C、D、E、M六种元素,原子序数依次增大.A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同;B是短周期中原子半径最大的主族元素;C元素基态原子核外的3p能级半充满;E是所在周期中电负性最大的元素;M是第四周期未成对电子最多的元素.试回答下列有关的问题:
已知:A、B、C、D、E、M六种元素,原子序数依次增大.A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同;B是短周期中原子半径最大的主族元素;C元素基态原子核外的3p能级半充满;E是所在周期中电负性最大的元素;M是第四周期未成对电子最多的元素.试回答下列有关的问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,由x g NO2和y g N2O4组成的混合气体中原子总数为3NA,则x+y=46 |
| B、1 mol氯气参加氧化还原反应,一定得到NA 或2NA个电子 |
| C、1升0.1 mol?L-1 NaBr溶液中,HBr和Br-总和为0.1NA个 |
| D、12.5 mL 16 mol?L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ClO2具有强氧化性,可用于自来水的杀菌消毒,优于氯气的高效安全性 |
| B、NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 |
| C、酒精能使蛋白质变性,医学上使用无水酒精来杀菌消毒 |
| D、Na2CO3能与盐酸反应,广泛用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| B、c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+) |
| C、c(Na+)>c (OH-)>c(CH3COO-)>c(H+) |
| D、c(Na+)>c (OH-)>c(H+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
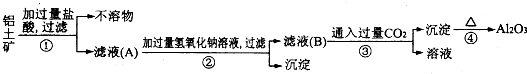
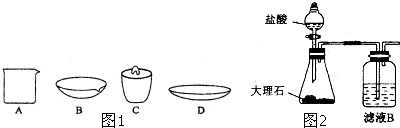
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | ① | ② | ③ | 实验结论 | 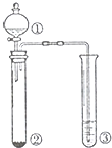 |
| A | 浓硫酸 | Cu | 品红溶液 | SO2具有漂白性 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、 氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸 >硅酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
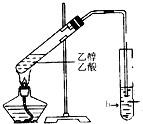 如图,在试管a中先加3mL乙醇,边摇动边缓缓加入2mL浓硫酸,摇匀冷却后,再加入2ml冰醋酸,充分搅动后,固定在铁架台上.在试管b中加入适量的A 溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.
如图,在试管a中先加3mL乙醇,边摇动边缓缓加入2mL浓硫酸,摇匀冷却后,再加入2ml冰醋酸,充分搅动后,固定在铁架台上.在试管b中加入适量的A 溶液.连接好装置,给a加热,当观察到试管b中有明显现象时,停止实验.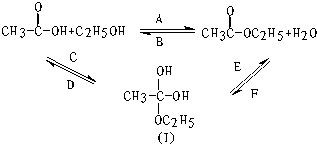
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com