
下列关于现有元素周期表的说法不正确的是( )
|
| A. | 编排的总原则是按元素的核电荷数递增的顺序排列,且将电子层数相同的元素排成同一行,将最外层电子数相同的排成同一列 |
|
| B. | 一个族就是一列,一个周期就是一个横行 |
|
| C. | 指导人们在金属与非金属元素的分界线附近寻找半导体材料 |
|
| D. | 指导人们在过渡元素中寻找合适的有机反应的催化剂 |
| 元素周期表的结构及其应用. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | A、编排的总原则是:①横行:把电子层数相同的各种元素,按原子序数递增的顺序从左到右排成横行;②纵行:再把不同横行中最外电子层的电子数相同的元素按电子层数递增的顺序由上而下排成纵行,这样得到的一个表,叫做元素周期表; B、第ⅥⅡ族为8、9、10三个纵列; C、在周期表金属与非金属分界线附近的元素,既具有金属性又具有非金属性; D、制耐高温合金元素、催化剂在元素周期表的过渡金属中能找到. |
| 解答: | 解:A、编排的总原则是:①横行:把电子层数相同的各种元素,按原子序数递增的顺序从左到右排成横行;②纵行:再把不同横行中最外电子层的电子数相同的元素按电子层数递增的顺序由上而下排成纵行,这样得到的一个表,叫做元素周期表,故A正确; B、第ⅥⅡ族为8、9、10三个纵列,故B错误; C、在周期表金属与非金属分界线附近的元素,既具有金属性又具有非金属性,可以用来做良好的半导体材料,如硅等,故C正确; D、制耐高温合金元素、催化剂在元素周期表的过渡金属中能找到,半导体在金属和非金属分界线处能找到,故D正确; 故选B. |
| 点评: | 本题考查元素周期表结构与元素周期律的应用,比较基础,注意把握元素周期表中列与族的关系. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是( )

A.原混合酸中N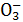 物质的量为0.1 mol
物质的量为0.1 mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+====3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为2.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 原子的最外层电子数是次外层电子数的3倍. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和. |
| E | 生产和生活中用量最大的金属. |
请根据信息回答有关问题:
(1)元素Y的核外电子排布式为 .
(2)元素X与Z可形成化合物XZ2,XZ2属于 晶体,电子式为 .
(3)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号) .
(4)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点最高的是(写化学式) .
(5)R的一种配合物的化学式为RCl3•6H2O.已知0.01mol RCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是 .
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(6)E能形成E2+和E3+两种价态的离子,检验E2+中含有 E3+的最佳试剂是 ,要除去E2+中E3+可加入 ,离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于太阳能、生物质能、氢能的说法不正确的是( )
|
| A. | 太阳能是地球上最基本的能源,绿色植物通过光合作用将太阳能转化成化学能 |
|
| B. | 农业上的秸秆、枝叶、水生植物、动物粪便及城市和工业的有机废弃物(如废弃塑料、橡胶等)都蕴藏着丰富的生物质能 |
|
| C. | 生物质能的利用主要有直接燃烧、生物化学转化、热化学转化等形式 |
|
| D. | 氢能是理想的清洁能源,但氢气的获取、贮存、运输等一直阻碍着人们大量利用氢能的步伐;贮氢合金的发现和利用,开辟了解决氢气贮存、运输难题的新途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
|
| A. | H2O的沸点比H2S的沸点高是因为O的非金属性比S的非金属性强 |
|
| B. | F2、Cl2、Br2、I2的沸点依次升高是因为它们分子间作用力依次增大 |
|
| C. | 离子化合物溶于水时离子键被破坏,共价化合物溶于水时共价键不一定改变 |
|
| D. | 只含共价键的物质不一定属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素A和B的原子序数都小于18.已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a﹣2b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有( )
|
| A. | 能与水反应 | B. | 能与氢氧化钠溶液反应 |
|
| C. | 能与硫酸反应 | D. | 能与碳酸钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及其能量变化,据此判断以下叙述中错误的是( )
A.化学反应的实质是旧化学键断裂和新化学键的形成
B.所有的化学变化一定遵循质量守恒和能量守恒
C.在化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是放热反应
D.化学键的变化必然会引起能量变化,所以能量变化也一定会引起化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 铁与稀硫酸反应:2Fe+6H+=2Fe3﹢+3H2↑ |
|
| B. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+H﹢=Al3﹢+H2O |
|
| C. | 碳酸氢钠溶液中加入氢氧化钠:HCO3﹣+OH﹣=CO32﹣+H2O |
|
| D. | 碳酸钙与稀硝酸反应:CO32﹣+2H+=CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com