
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法不正确的是
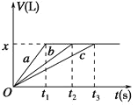
A. x=2.24
B. 三种金属的物质的量均为0.2 mol
C. 反应时,Na、Mg、Al均过量
D. 曲线b为Mg与盐酸反应的图象
【答案】C
【解析】
由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数应该是不一样的,比值应是1:2:3,所以推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余。
A.由于酸不足,所以生成氢气的量为:n(H2)= ![]() n(HCl)=0.1 mol,所以标况下的体积为2.24 L,A正确;
n(HCl)=0.1 mol,所以标况下的体积为2.24 L,A正确;
B.生成0.1 mol的氢气需0.2 mol的钠,因此三种金属的物质的量均为0.2 mol,B正确;
C.Na不可能过量,若Na过量会与溶剂水反应,C错误;
D.按照金属活动性顺序,Na>Mg>Al,则中间那条线是Mg与盐酸反应的图象,D正确;答案选C。


科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =__________________。
(2)该反应为__________反应(“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl2在70℃的NaOH水溶液中,能发生氧化还原反应后可生成NaClO与NaClO3现有63.9g Cl2,将其通入到足量70℃的NaOH水溶液中,反应完全后测得溶液中NaClO与NaClO3的物质的量比为4:1,并得到500mL溶液。
(1)写出Cl2在70℃的NaOH水溶液中发生上述反应的化学方程式______。
(2)计算完全反应后溶液中NaClO、NaClO3物质的量浓度____、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ______
(2)该反应为 ______ 反应(选填“吸热”“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是 ______ .
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为 ______ ℃.在此温度下2L密闭容器中进行反应CO2(g)+H2(g)CO(g)+H2O(g),CO2(g)和H2(g)的起始量均为2.0mol,达到平衡时CO2的转化率为 ______ .
(5)在密闭容器中进行反应①Fe(s)+CO2(g)FeO(s)+CO(g)△H1=akJmol-1
反应②2CO(g)+O2(g)2CO2(g)△H2=b kJmol-1
反应③2Fe(s)+O2(g)2FeO(s)△H3
则△H3= ______ (用含a、b的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用苯甲醛(C6H5CHO)在NaOH溶液中可以制苯甲醇(C6H5CH2OH)和苯甲酸(C6H5COOH)。实验流程如图:
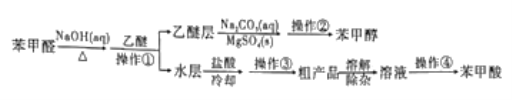
相关物质的性质如下表所示。回答下列问题:
物质 | 对水的相对密度 | 沸点 | 溶解性 |
苯甲醇 | 1.04 | 205.7 | 微溶于水,易溶于乙醚 |
苯甲酸 | 1.27 | 249 | 微溶于冷水,可溶于热水,易溶于乙醚 |
乙醚 | 0.71 | 34.6 | 与水互不相溶 |
(1)操作①中,需要用到的玻璃仪器除烧杯外,还有____。操作①后,苯甲醇在容器中混合物的_____(填“上”或“下”)层。
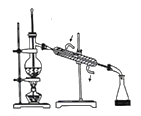
(2)乙醚层用10%Na2CO3溶液洗涤的目的是_____。操作②前常需要加入MgSO4,作用是______。操作②的装置如图,指出该装置图中两个错误:______。
(3)操作③是______,操作④是______。
(4)取106.00g苯甲醛反应,若苯甲醛的转化率为80%,乙醚的萃取率为100%,洗涤等过程损失率为10%,则最终可制得苯甲醇___g(结果保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,该同学在操作时的一个错误是__,烧杯的实际质量为__(最小砝码为5g)。

(2)已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释100倍(体积之比)后使用。请回答下列问题:
有效成分 | NaClO |
规格 | 1000mL |
质量分数 | 25% |
密度 | 1.19g·cm-1 |
①该“84”消毒液物质的量浓度约____ mol·L-1(保留一位小数)。
②某同学取20mL该“84”消毒液,稀释后用于消毒,稀释后的溶液中c(Na+)=__mol·L-1。
③“84”消毒液与稀硫酸混合使用可增强消毒能力,某消毒小组人员用浓硫酸配制稀硫酸用于增强“84”消毒液的消毒能力,下列操作使所配制的硫酸溶液浓度偏低的是__。
a.量取浓硫酸时,俯视量筒刻度线 b.未经冷却就将溶液转移至容量瓶
c.溶液定容摇匀后,有少量流出 d.没有洗涤量取浓硫酸的量筒
e.定容时仰视容量瓶刻度线 f.容量瓶内残留一定量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是
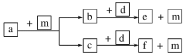
A.原子半径:W<X<Y<Z
B.阴离子的还原性:Y>W
C.图中物质的转化过程均为氧化还原反应
D.a一定只由W、X两种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E 都为短周期元素,A 原子失去一个电子后成为一个质子;C 的-1 价阴离子与氖原子具有相同的电子层结构;D在C 的下一周期,D可与同周期的B形成 BD2型离子化含物;E 和 C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是____________。
(2)A与 E 形成的最简单化合物的电子式为____________。
(3)C的氢化物与 D的氢化物的沸点相比较: ____________(用化学式表示,且用>符号连接)。 解释原因______________。
(4)E 的氢化物与 E 的最高价氧化物对应水化物反应的生成物中含有的的化学键有____________。
(5)E 的最高价氧化物对应的水化物的稀溶液与过量铁粉发生反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A. 标准状况下,22.4LH2O含有的分子数为1 NA
B. 常温常压下,16g O2含有的原子数为1 NA
C. 通常状况下,1NA 个SO2分子占有的体积约为22.4L
D. 物质的量浓度为0.5mol/L的K2SO4溶液中,含有SO42-个数为0.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com