
| 选项 | A | B | C | D |
| 实验目的 | 验证HCl水溶液的酸性 | 检验葡萄糖的醛基 | 配制一定质量分数的AlCl3水溶液 | 测定中和反应的反应热 |
| 实验方案设计 |  |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.HCl极易溶于水,应该使用防倒吸装置;
B.该反应需要在碱性条件下进行,加入的氢氧化钠溶液应该过量;
C.铝离子易水解,应加入少量稀盐酸抑制铝离子水解;
D.缺少搅拌仪器-环形玻璃搅拌棒.
解答 解:A.氯化氢极易溶于水,该装置中易发生倒吸现象,应该采用防倒吸装置,故A错误;
B.醛与氢氧化铜浊液的反应需要在碱性条件下进行,配制氢氧化铜浊液时应该加入过量氢氧化钠溶液,故B错误;
C.配制一定质量分数的AlCl3水溶液时,为了抑制铝离子水解,需要加入少量稀盐酸,图示侧重合理,故C正确;
D.中和热测定中需要用环形玻璃搅拌棒搅拌,图示装置中缺少环形玻璃搅拌棒,故D错误;
故选C.
点评 本题考查化学实验方案的评价,题目难度不大,涉及盐的水解原理应用、中和热测定、物质检验等知识,明确常见化学实验基本操作方法即可解答,试题侧重基础知识的考查,培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:多选题
| A. | 平衡时N2的转化率:α甲>2α乙 | B. | 平衡时NH3的浓度:2c甲<c乙 | ||
| C. | 平衡时体系压强:2p甲>p乙 | D. | 反应放出的热量:2Q甲>Q乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
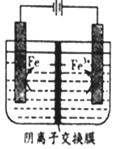
| A. | .阳极主要发生反应:Fe2+-e-═Fe3+ | |
| B. | 可用高纯铁电极作阴扱 | |
| C. | .电解液中的SO42-由右向左通过阴离子交换膜 | |
| D. | .电解法制备髙纯铁总反应:3Fe2+$\frac{\underline{\;通电\;}}{\;}$Fe+2Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,该分子中含有官能团的名称是羟基、羧基、羰基和碳碳双键,该分子不能发生消去反应(填“能”或者“不能”).二噁英是一类物质的统称,这类物质的母体结构为
,该分子中含有官能团的名称是羟基、羧基、羰基和碳碳双键,该分子不能发生消去反应(填“能”或者“不能”).二噁英是一类物质的统称,这类物质的母体结构为 ,其中苯环上的氢原子如果被氯原子取代,所得到的物质毒性是KCN的100倍.该分子中含有官能团的名称是氯原子、醚键.
,其中苯环上的氢原子如果被氯原子取代,所得到的物质毒性是KCN的100倍.该分子中含有官能团的名称是氯原子、醚键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 实验现象 | 实验结论 |
| I:取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 | 溶液X中含有钠离子 | |
| II:取少许溶液X于一支试管中,滴加先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液), | 溶液X中含有氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯和饱和溴水制溴苯 | |
| B. | 用浓盐酸和铁粉制少量氢气 | |
| C. | 用NaOH溶液除去MgC12溶液中的AlC13杂质 | |
| D. | 用右图所示装置制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.
将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ.mol-1) | 414 | 489 | ? | 155 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 5 | C. | 4 | D. | 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com