
【题目】下列离子方程式书写正确的是![]()
A.氯化钙溶液中通入![]() 气体:
气体:![]()
B.以石墨作电极电解氯化铝溶液:![]()
![]()
![]()
C.![]() 溶液中通入过量的
溶液中通入过量的![]() 气体:
气体:![]()
D.向明矾溶液中加入氢氧化钡溶液至沉淀的质量最大:![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
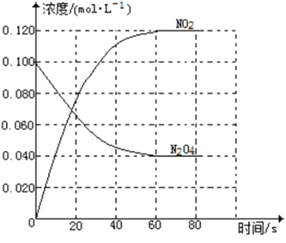
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1 ℃和T2 ℃时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )

A.该平衡体系的化学反应方程式为:A(g)+B(g)![]() C(g)
C(g)
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动
C.T1<T2
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)检验气体中是否含有CO的实验操作:将该气体通入氯化钯(PdCl2)溶液中,观察是否有黑色的单质钯生成,写出对应的化学方程式:_______________。
(2)生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式:_________________。
(3)加入双氧水能提高软锰矿(主要成分是MnO2)的浸出率,锰转化成Mn2+。写出酸性条件下双氧水提高软锰矿浸出率的离子方程式:______________________________。
(4)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿(主要成分为CuFeS2)转化成硫酸盐,该过程反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列相关离子方程式书写正确的是![]()
A.![]() 溶液与少量的氢氧化钠溶液混合加热:
溶液与少量的氢氧化钠溶液混合加热:![]()
B.向![]() 溶液中加入过量的澄清石灰水:
溶液中加入过量的澄清石灰水:![]()
C.等物质的量的![]() 和
和![]() 在溶液中的反应:
在溶液中的反应:![]()
D.“84消毒液”和“洁厕灵”![]() 主要成分为盐酸
主要成分为盐酸![]() 混合使用会产生有毒气体:
混合使用会产生有毒气体:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Cu、N、B等元素组成的新型材料有着广泛用途。
(1)基态 Cu+ 的核外电子排布式为____________。在高温下CuO 能分解生成Cu2O,试从原子结构角度解释其原因:_______________________________。
(2)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,它属于____晶体。
(3)化合物A (H3BNH3) 是一种潜在的储氢材料,它可由六元环状化合物 (HB=NH)3通过3CH4+ 2 (HB=NH)3+ 6H2O →3CO2 + 6H3BNH3 制得。
①与上述化学方程式有关的叙述不正确的是_________。(填标号)
A.反应前后碳原子的轨道杂化类型不变 |
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
C.第一电离能:N>O>C>B |
D.化合物A中存在配位键 |
②1个 (HB=NH)3分子中有__个σ键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________。图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。
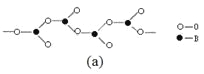
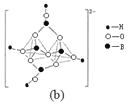
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等量的N2和H2的混合气体分别充入甲、乙、丙三个容器中,进行反应![]() ,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
,经过相同的时间后,测得反应速率分别为甲:v(H2)=1 mol·L-1·min-1,乙:v(N2)=2 mol·L-1·min-1,丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率大小关系为( )
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,能实现实验目的的是(必要时可加热)( )
选项 | 实验目的 | 甲中物质 | 乙中物质 | 丙中物质 |
|
A | 证明浓硫酸具有强氧化性 | 浓硫酸 | 碳粉 | 溴水 | |
B | 验证Cl2无漂白性 | 浓盐酸 | MnO2 | 干燥的红色布条 | |
C | 比较H2CO3和H2SiO3的酸性 | 稀硫酸溶液 | 碳酸钠 | 硅酸钠溶液 | |
D | 验证NH3溶于水显碱性 | 浓氨水 | 碱石灰 | 湿润的蓝色 石蕊试纸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是( )

A.若D中无水硫酸铜变蓝,则说明Na2O2与H2反应生成水
B.装置B中盛放浓硫酸,目的是除去A中挥发出来的少量水蒸气
C.装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D.装置A也可直接用于二氧化锰与浓盐酸反应制取氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com