
| A. | 含有盐酸的洁厕剂和含有次氯酸钠的消毒液混用可以增强洗涤和消毒的效果 | |
| B. | 过量的Fe和Cu在等物质的量的Cl2中燃烧,转移的电子数相等 | |
| C. | 等体积、等浓度的NH4Cl溶液和稀氨水中,所含NH4+的数目相等 | |
| D. | 等物质的量的过氧化钡(BaO2)和Ba(OH)2固体中,阴阳离子个数比均为2:1 |
分析 A.含有盐酸的洁厕剂主要成分为盐酸,含有次氯酸钠的消毒液混用,会在酸溶液中氯离子和次氯酸根离子发生氧化还原反应生成有毒气体氯气;
B.过量铁和铜与等物质的量氯气反应,反应电子转移依据反应的氯气计算;
C.等体积、等浓度的NH4Cl溶液和稀氨水中,一水合氨电离程度大于铵根离子的水解程度,溶液显碱性,但一水合氨是弱电解质存在微弱电离;
D.过氧化钡(BaO2) 钡离子和过氧根离子构成分析;
解答 解:A.含有盐酸的洁厕剂主要成分为盐酸,含有次氯酸钠的消毒液混用,会在酸溶液中氯离子和次氯酸根离子发生氧化还原反应生成有毒气体氯气,Cl-+ClO-+2H+=Cl2↑+H2O,不能增强洗涤和消毒的效果,产生有毒气体引起危险,故A错误;
B.过量铁和铜与等物质的量氯气反应,反应电子转移依据反应的氯气计算,反应的氯气相同,Cl2~2Cl-~2e-,电子转移数相同,故B正确;
C.等体积、等浓度的NH4Cl溶液和稀氨水中,一水合氨电离程度大于铵根离子的水解程度,溶液显碱性,一水合氨是弱电解质存在微弱电离,氯化铵溶液中铵根离子浓度大于一水合氨溶液中铵根离子浓度,故C错误;
D.过氧化钡(BaO2) 钡离子和过氧根离子构成,阴阳离子个数比均为1:1,故D错误;
故选B.
点评 本题考查了氯及其化合物性质、物质结构、氧化还原反应电子转移计算、弱电解质电离平衡的分析判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 要除去氯化镁酸性溶液里少量的氯化铁,可以选用氢氧化钠 | |
| B. | 镀锡铁表面有划痕是,仍然能阻止铁被氧化 | |
| C. | 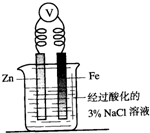 向图烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,一段时间后可看到Fe电极附近有蓝色沉淀生成 | |
| D. | 各种原生铜的硫化物经氧化、淋滤作用变成硫酸铜,遇到深层的ZnS和PbS,便慢慢地使之转变为CuS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应的实质是电子转移 | B. | 氧化剂在反应中本身被还原 | ||
| C. | 氧化反应和还原反应同时进行 | D. | 氧化还原反应一定有单质参加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1g甲烷和1g氧气的原子数之比为5:1 | |
| B. | 同温同压下甲烷和氧气的密度之比为2:1 | |
| C. | 等物质的量的甲烷和氧气的质量之比为2:1 | |
| D. | 在标准状况下等质量的甲烷和氧气的体积之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
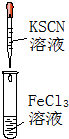 | 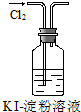 | 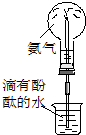 | 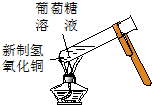 |
| ① | ② | ③ | ④ |
| A. | 实验①试管中混合溶液中出现红色沉淀 | |
| B. | 实验②中溶液变黄色 | |
| C. | 实验③中烧瓶内溶液变红色 | |
| D. | 实验④中出现黑色氧化铜固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
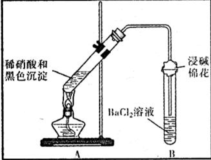 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该电池放电时,正极的电极反应为O2+4H++4e-═2H2O | |
| B. | 该电池充电时,阴极发生了氧化反应:Li++e-═Li | |
| C. | 电池中的有机电解液可以用稀盐酸代替 | |
| D. | 正极区产生的LiOH可回收利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com