
分析 (1)碘酒为溶液分散系;
(2)混合后溶液呈碱性,生成强碱弱酸盐,则HIO为弱酸;
(3)碘的化合价为+3、+5两种价态,其化学式为I(I03)3,以此计算;
(4)KI03与KI在酸性溶液中发生氧化还原反应生成碘,淀粉遇碘变蓝,证明加碘食盐中存在IO3-,可选碘化钾淀粉试纸、酸即可.
解答 解:(1)碘酒为溶液分散系,分散质粒子的大小为小于1nm,故答案为:a;
(2)混合后溶液呈碱性,生成强碱弱酸盐,则HIO为弱酸,则次碘酸在水中的电离方程式为HIO?H++IO-,该混合溶液呈弱碱性的原因是IO-+H2O?HIO+OH-,
故答案为:HIO?H++IO-;IO-+H2O?HIO+OH-;
(3)碘的化合价为+3、+5两种价态,其化学式为I(I03)3,其摩尔质量为127g/mol×2+16g/mol×9=398g/mol,故答案为:398g/mol;
(4)KI03与KI在酸性溶液中发生氧化还原反应生成碘,离子反应为I03-+5I-+6H+=3I2+3H2O,淀粉遇碘变蓝,证明加碘食盐中存在IO3-,可选③⑤检验,操作为取少量食盐,滴加食醋,然后将混合液滴在碘化钾淀粉试纸上,试纸变蓝,则含有,
故答案为:I03-+5I-+6H+=3I2+3H2O;③⑤;取少量食盐,滴加食醋,然后将混合液滴在碘化钾淀粉试纸上,试纸变蓝,则含有.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应及检验方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
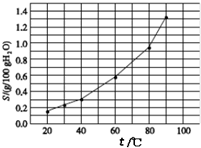
| A. | 温度升高不利于溴酸银的溶解 | |
| B. | 溴酸银的溶解是放热过程 | |
| C. | 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 | |
| D. | 60℃时,将0.04g溴酸银加入到10g水中,形成的分散系中存在沉淀溶解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
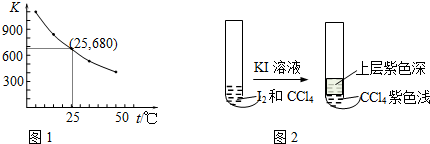
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是N2(g)+3H2(g)═2NH3(g)在反应过程中的反应速率v与时间(t)的关系曲线,下列说法错误的是( )
如图是N2(g)+3H2(g)═2NH3(g)在反应过程中的反应速率v与时间(t)的关系曲线,下列说法错误的是( )| A. | t1时,正方向速率大于逆反应速率 | |
| B. | t2时,反应体系中NH3的浓度达到最大值 | |
| C. | t2-t3时间段,正反应速率等于逆反应速率 | |
| D. | t2-t3时间段,各物质的浓度相等且不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
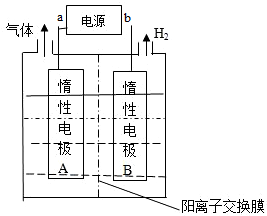
| A. | 外加电源的a极为正极 | |
| B. | 电解过程中,Li+向B极迁移 | |
| C. | 阳极反应式为:4OH--4e-═O2↑+H2O | |
| D. | 每生成1molLiOH,外电路转移1mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com