
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g) p C(g)+q D(g)。
p C(g)+q D(g)。
(1)若开始时加入A物质m mol,B物质n mol,则达到平衡时 A、B的转化率____________.(填“相等”或“不等”)
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间T的关系如图3所示。则T1(填“>”、“<”或“=”) T2,该反应的正反应的△H(填“>”、“<”或“=”) 0。

(3)一定条件下,从正反应开始达到化学平衡过程中,混合气体的平均相对分子质量随时间的变化如图4所示,测得达到平衡时A、B、C、D的物质的量均为1 mol。
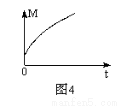
①若在恒温恒容的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、“不变”或“无法确定”)______ 。
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1 mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”) 。
(4)若该反应的逆反应速率与时间的关系如下图所示:
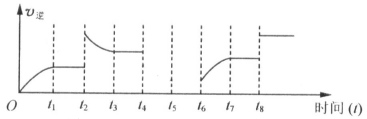
可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了条件,试判断t2时改变的条件是 。
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:2016届河北省高三上学期12月月考化学试卷(解析版) 题型:实验题
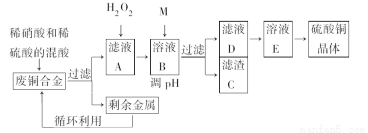
(2011·石家庄一模,29)实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体(CuSO4·xH2O),方案如下:
金属离子生成氢氧化物沉淀的pH可参考下列数据:
Fe3+ | Fe2+ | Cu2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 5.2 | 3.7。] |
完全沉淀时的pH | 3.2 | 9.0 | 6.7 | 4.7 |
请回答:
(1)写出加入混酸后,合金中铜溶解的离子方程式____________________。
(2)若溶解合金时加入的混酸由2 L 3 mol·L-1硫酸和1 L 2 mol·L-1硝酸混合而成,则反应后生成标准状况下的NO的体积最多为________L。
(3)加入H2O2的目的是________。
(4)为保证产品的纯度,M物质最好选用________(填字母),调节pH的范围为________。
a.Cu(OH)2 b.H2SO4
c.NH3·H2O d.Na2CO3
(5)滤液D中加入硫酸的目的为_________________________________。
(6)从溶液E制得CuSO4·xH2O晶体所需要的步骤为________、________、过滤、干燥。
(7)要测定所得硫酸铜晶体CuSO4·xH2O中x的值,下列说法不正确的是________(填字母)。
a.称量操作至少要进行4次
b.需将坩埚放在石棉网上进行加热
c.加热后,将坩埚放在石棉网上冷却,会使所测x的值偏小
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上第三次模拟考试化学试卷(解析版) 题型:填空题
Ⅰ.(1) P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是______
a.NH3 b.HI c.SO2 d.CO2
(2)工业生产甲醇的常用方法是:CO(g)+2H2(g)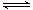 CH3OH(g) △H1 = —90.8kJ/mol。
CH3OH(g) △H1 = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H2 = -571.6kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H3= -566.0kJ/mol
计算2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H4 = 。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn == Fe2O3 +ZnO +2K2ZnO2
该电池正极发生的反应的电极反应式为 。
II.用如图所示装置进行实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
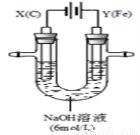
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe - 6e- + 8OH-=FeO42- + 4H2O 和 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川九中高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是 ( )
A.lmol FeI2与足量氯气反应时转移的电子数为2NA
B.室温下,14.0g分子通式为CnH2n烯烃中含有的碳碳双键数目为NA/n
C.标准状况下,5.6 L O2与适量Na加热反应,转移的电子数一定为NA
D.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上12月月考化学试卷(解析版) 题型:填空题
有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复) 提示:CH3COONH4溶液为中性
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是______ ,B是_______ 。
(2)25℃时,0.1mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)= _______(用含a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为__________ _________。
(4)在一定体积0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是 ____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上12月月考化学试卷(解析版) 题型:填空题
结合下表回答下列问题(均为25℃时的数据)
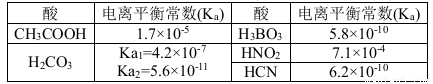
(1)上述五种酸中,酸性最强的是 (填化学式)。HCO3-的电离平衡常数表达式K= 。
(2)已知硼酸(H3BO3)与足量NaOH溶液发生酸碱中和反应的离子方程式为:H3BO3+ OH-= B(OH)4-, 则硼酸为 元酸,硼酸的电离方程式为 。
(3)常温下,0.01 mol·L-1的HNO2 溶液加水稀释的过程中,下列各项数据增大的是 (填代号)。
①c(H+ ) ②c (NO2- )/ c(H+) ③Ka(HNO2)
④c(H+ )/ c(HNO2) ⑤c(OH -) ⑥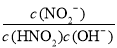
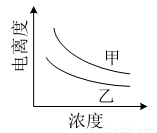
(4)右图描述的是醋酸与HNO2 在水中的电离度与浓度关系,其中反映醋酸的是曲线 (填“甲”或“乙”,已知:电离度=已电离的溶质分子数/原有溶质分子总数) 。
(5)根据表中提供的数据可知,在溶液中能大量共存的微粒组是 (填代号)。
A. H2CO3、HCO3-、 CH3COO-、CN- B. HCO3-、 CH3COOH、CN- 、CO32—
C. HCN、 HCO3-、CN- 、CO32— D. HCN、 HCO3-、CH3COO-、CN-
(6)设计一个现象明显、操作简便的实验方案证明HNO2酸性强于碳酸(不用叙述仪器和具体操作)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷(解析版) 题型:选择题
在一定的温度下, 向一密闭容器中放入 1 mol A 和 1 mol B, 发生下列反应:A(g) + B(g) 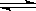 C(g) + 2D(g),达到平衡状态时,C的含量为 m%,保持温度和体积不变,若按照下列配比在上述容器放入起始物质,达到平衡状态时C的含量仍然为m%的是
C(g) + 2D(g),达到平衡状态时,C的含量为 m%,保持温度和体积不变,若按照下列配比在上述容器放入起始物质,达到平衡状态时C的含量仍然为m%的是
A.2mol A + 1mol B
B. 1mol C + 1mol D
C.2mol C + 2mol D
D.0.5mol A +0.5mol B +0.5mol C +1mol D
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上月考化学试卷(解析版) 题型:选择题
下列进行性质比较的实验,不合理的是( )
A.比较Cu、Fe的还原性:铜加入硫酸铁溶液中
B.比较镁、铝的金属性:取一小段去氧化膜的镁带和铝片,分别加入1.0 mol·L-1的盐酸中
C.比较高锰酸钾、氯气的氧化性:高锰酸钾中加入浓盐酸
D.比较氯、溴的非金属性:溴化钠溶液中通入氯气
查看答案和解析>>
科目:高中化学 来源:2016届广东省中山市等七校联合体高三上学期12月联合化学试卷(解析版) 题型:选择题
2015年10月5日诺贝尔医学奖授予中国女药学家屠呦呦及美国科学家威廉·坎贝尔和日本大村智,以表彰他们在寄生虫疾病治疗方面取得的成就。屠呦呦1971 年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命。青蒿素分子结构如图。下列说法错误的是:
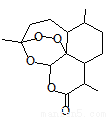
A.青蒿素的分子式为C15H22O5
B.青蒿素是芳香族化合物
C.青蒿素可以发生水解反应
D.青蒿素不能使酸性KMnO4溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com