

分析 (1)氢氧化铝可以溶解于氢氧化钠中,但是氢氧化镁不会溶解;偏铝酸钠可以和盐酸之间反应生成氢氧化铝;
(2)偏铝酸钠中通入二氧化碳会发生反应生成碳酸钠、氢氧化铝沉淀,据此书写反应;
(3)根据产生沉淀的量的变化以及沉淀的溶解情况确定先后滴加的试剂;
(4)氯化镁中氯离子物质的量是氯化镁物质的量的2倍,氯化铝中,氯离子物质的量是氯化铝物质的量的3倍,根据沉淀的量结合元素守恒来回答;
(5)先计算硫酸铝铵晶体质量,根据化学式计算结晶水中水的质量,结合400℃时固体质量差,计算晶体中剩余结晶水的质量,进而计算剩余固体中n[((NH4)2Al2(SO4)4]:n(H2O),据此确定化学式.
解答 解:(1)加入的试剂能立即产生沉淀,并且沉淀的量达到最大,然后沉淀溶解,根据氢氧化铝可以溶解于氢氧化钠中,但是氢氧化镁不会溶解;偏铝酸钠可以和盐酸之间反应生成氢氧化铝的性质,确定AB段所表示的反应的离子方程式是:Al(OH)3+OH-═AlO2-+2H2O,CD段所表示的反应的离子方程式是:AlO2-+H++H2O═Al(OH)3↓,故答案为:Al(OH)3+OH-═AlO2-+2H2O;AlO2-+H++H2O═Al(OH)3↓;
(2)沉淀量达到最小后,氢氧化铝全部转化为偏铝酸钠,通入二氧化碳会发生反应:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-,故答案为:AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-;
(3)加入的试剂能立即产生沉淀,并且沉淀的量达到最大,然后沉淀溶解,根据氢氧化铝可以溶解于氢氧化钠中,但是氢氧化镁不会溶解;偏铝酸钠可以和盐酸之间反应生成氢氧化铝的性质,确定a是NaOH,b是HCl,根据图象,结合图象消耗的酸碱体积的完全的对称的特点,根据反应实质:NaOH~Al(OH)3~AlO2-~H+,得到:盐酸和氢氧化钠的浓度之比是1:1,故答案为:1:1;
(4)原混合液中,加入氢氧化钠产生的氢氧化铝和氢氧化镁的物质的量是相等的,根据元素守恒,所以氯化镁和氯化铝的物质的量是相等的,氯化镁中氯离子物质的量是氯化镁物质的量的2倍,氯化铝中,氯离子物质的量是氯化铝物质的量的3倍,所以c(Al3+):c(Mg2+):c(Cl-)=1:1:5,故答案为:1:1:5;
(5)4.53g硫酸铝铵晶体的物质的量为$\frac{4.53g}{906g/mol}$=0.005mol,
4.53g硫酸铝铵晶体中水的质量为0.005mol×24×18g/mol=2.16g,
加热400℃时固体质量减少△m=4.53g-2.46g=2.07g<2.16g
剩余固体中结晶水的物质的量为$\frac{2.16g-2.07g}{18g/mol}$=0.005mol,
剩余固体中n[(NH4)2Al2(SO4)4]:n(H2O)=0.005mol:0.005mol=1:1,
故400℃时剩余固体成分的化学式为(NH4)2Al2(SO4)4•H2O.
故答案为:(NH4)2Al2(SO4)4•H2O.
点评 本题考查了镁、铝重要化合物的性质、根据化学式的计算等知识,题目难度较大,能正确分析图象中转折线发生的化学反应是解本题的关键,试题有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按如图装置进行如下实验,请用你所学知识完成下题:
按如图装置进行如下实验,请用你所学知识完成下题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
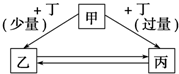 甲、乙、丙、丁均为中学化学中常见的物质,它们之间存在如图所示的转化关系(部分产物略去),甲不可能是( )
甲、乙、丙、丁均为中学化学中常见的物质,它们之间存在如图所示的转化关系(部分产物略去),甲不可能是( )| A. | NaOH溶液 | B. | Fe | C. | Al2O3 | D. | C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2
现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2| 分类标准 | 金属单质 | 氧化物 | 溶液 | 电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | r(S2-)>r(O2-)>r(F-) | B. | r(Al)>r(Mg)>r(Na) | C. | r(Na+)>r(O2-)>r(F-) | D. | r(Na)>r(Na+)>r(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的浓度之比为1:3:3 | |
| B. | 混合物各物质的浓度相等 | |
| C. | ν(A)、ν(B)、ν(C) 之比为1:3:3 | |
| D. | A、B、C三种物质的浓度不随时间变化而变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com