
| A、取等体积的醋酸和盐酸,分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m<n |
| B、取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率:盐酸大于醋酸 |
| C、取等体积的两种酸,分别用完全一样的NaOH溶液进行中和,醋酸消耗NaOH的物质的量比盐酸消耗的多 |
| D、两种酸中c(CH3COO-)>c(Cl-) |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、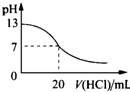 此图表示25℃时,用0.1mol/L盐酸滴定20mL 0.1mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线 |
B、 此图表示一定条件下进行的反应2SO2(g)+O2(g)═2SO3(g)△H<0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 |
C、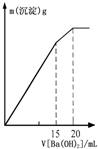 此图表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
D、 此图表示化学反应H2(g)+C12(g)═2HCl(g)的能量变化,则该反应的反应热△H=﹢183kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,32克氧气中原子个数为2NA |
| B、标准状况下,1mol H2O的体积为22.4L |
| C、常温常压下,1molH2的质量为2克 |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有的Cl-数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X不一定含有SO42- |
| B | 向FeCl3+3KSCN═Fe(SCN)3+3KCl溶液平衡体系中加入少量固体KCl | 体系颜色无变化 | KCl不能使该平衡移动 |
| C | 向浓度均为0.1mol?L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com