
铁及其化合物是中学化学中的一类重要物质,下列关于铁元素的叙述中正确的是( )
A.2Fe3++Fe===3Fe2+成立说明氧化性:Fe3+>Fe2+
B.25 ℃,pH=0的溶液中,Al3+、NH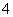 、NO
、NO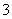 、Fe2+可以大量共存
、Fe2+可以大量共存
C.5.6 g铁与足量的氯气反应失去电子为0.2 mol
D.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+===Fe3++4H2O
科目:高中化学 来源: 题型:
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列说法合理的是( )
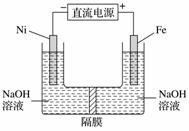
A.铁是阳极,电极反应为Fe-2e-+2OH-===Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.若隔膜为阴离子交换膜,则电解后左侧溶液中含有FeO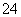
D.每制得1 mol Na2FeO4,理论上可以产生67.2 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
(1)FeCl3蚀刻铜箔反应的离子方程式为_____________________________________。
(2)过程Ⅰ加入铁屑的主要作用是________________________________________________________________________,
分离得到的固体主要成分是________________________________________________________________________,
从固体中分离出铜需采用的方法是________________________________________________________________________。
(3)过程Ⅱ中发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.工业上电解熔融状态的Al2O3制备Al涉及氧化还原反应(2012·广东理综,10B)
B.四川灾区重建使用了大量钢材,钢材是合金(2009·广东,5②)
C.金属材料都是导体,非金属材料都是绝缘体(2008·山东理综,9A)
D.合金材料中可能含有非金属元素(2009·山东理综,9A)
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是人类应用较早,当前应用量最大的金属元素。下列有关铁及其化合物的有关说法中正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D.Fe3+与KSCN产生血红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下。
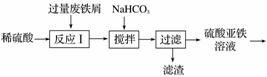
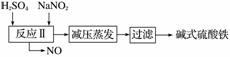
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题。
(1)加入少量NaHCO3的目的是调节pH,使溶液中的______沉淀,该工艺中“搅拌”的作用是__________。
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH)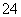 。该水解反应的离子方程式为__________________。
。该水解反应的离子方程式为__________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO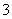 。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A.氯水 B.KSCN溶液
C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家发现,某些高温油炸食品中含有一定量的CH2===CH—O—NH2(丙烯酰胺)。食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:①能使酸性KMnO4溶液退色;②能发生加聚反应生成高分子化合物;③只有4种同分异构体;④能与氢气发生加成反应。其中正确的是 ( )。
A.①②③ B.②③④
C.①③④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。
①将“可燃冰”从海底取出,“可燃冰”融化即可放出甲烷气体。试解释其原因:_______________________________________________________。
②取356 g分子式为CH4·9H2O的“可燃冰”,将其释放的甲烷完全燃烧生成液态水,可放出1 780.6 kJ的热量,则甲烷的燃烧热为 。
(2)设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近科学家制造了一种燃料电池,一个电极通入空气,另一电极通人液化石油气(以C4H10表示)。电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。
①已知该电池的负极反应为C4H10+13O2--26e-===4CO2+5H2O,则该电池的正极反应为_________________________________________________,
电池工作时,电池中O2-向 极移动。
②液化石油气燃料电池最大的障碍是氧化反应不完全而产生的 (填写物质的名称)堵塞电极的气体通道。
(3)能源的紧缺在很大程度上制约了我国的经济发展。请你提出解决能源紧缺问题的两点建议____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com