
分析 根据价层电子对互斥理论确定中心原子杂化方式,价层电子对个数(n)=配原子个数+孤电子对个数.
根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;sp3杂化是四面体构型,sp2杂化,分子呈平面三角形.
解答 解:甲醛中C原子形成3个σ键,为sp2杂化,是平面三角形结构,键角为120°,甲醇分子内碳原子形成4个σ键,无孤电子对,杂化方式为sp3杂化,是四面体结构,O-C-H键角约为109°28′,键角小于120°,所以甲醇分子内O-C-H键角比甲醛分子内O-C-H键角小,
故答案为:sp3;小于.
点评 本题考查了原子的杂化方式,题目难度不大,注意把握价层电子对数的判断方法.


科目:高中化学 来源: 题型:选择题
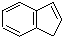 .下列关于茚的说法中不正确的是( )
.下列关于茚的说法中不正确的是( )| A. | 茚能使酸性高锰酸钾溶液褪色 | |
| B. | 茚能使溴的四氯化碳溶液褪色 | |
| C. | 1 mol茚只含有1 mol碳碳双键 | |
| D. | 茚中所有的原子均可能处在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.80g | B. | 0.02g | C. | 0.23g | D. | 0.46g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | 完全燃烧的产物中n(CO2):n(H2O)=2:1 28<Mr(A)<60 不能使溴的四氯化碳溶液褪色 一氯代物只有1种结构 |
| B | 饱和链烃,通常情况下呈气态 二溴代物有3种 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:干冰、冰水共存物、烧碱、小苏打 | |
| B. | 非电解质:乙醇、四氯化碳、氯气、葡萄糖 | |
| C. | 同素异形体:活性炭、C60、石墨烯、金刚石 | |
| D. | 混合物:铝热剂、纯净矿泉水、分析纯盐酸、漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com