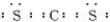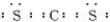X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己; 0.1mol?L-1丁溶液的pH为13(25℃).下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y元素在周期表中的位置为第三周期第ⅣA族
C.1mol甲与足量的乙完全反应共转移了1mol电子
D.1.0L0.1mol?L-1戊溶液中阴离子总的物质的量小于0.1mol
【答案】分析:首先应该从突破口找出X、Y、Z、W四种元素,“0.1 mol?L-1丁溶液的pH为13(25℃).”是重要突破口,丁是一元强碱且其中的金属元素在短周期,甲+乙=丁+己,甲+丙=戊+己;这两个方程式不难看出“己”是氧气,“丁”是氢氧化钠,那么甲是Na2O2、乙是水,丙是二氧化碳,戊是碳酸钠,因此X为氢、Y为碳、Z为氧、W为钠元素.
根据它们在元素周期表中的位置和其它性质就不难判断各选项了.
解答:解:由0.1 mol?L-1丁溶液的pH为13(25℃),丁是一元强碱且其中的金属元素在短周期,甲+乙=丁+己,甲+丙=戊+己;则“己”是氧气,“丁”是氢氧化钠,那么甲是Na2O2、乙是水,丙是二氧化碳,戊是碳酸钠,因此X为氢、Y为碳、Z为氧、W为钠元素;
A、由以上分析可知:X为氢、Y为碳、Z为氧、W为钠元素,则原子半径大小顺序为:Na>C>O>H,即:W>Y>Z>X,故A错误;
B、Y为碳,在周期表中的位置为:第二周期第ⅣA族,故B错误;
C、甲与足量的乙完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,1molNa2O2反应转移的电子为1mol,故C正确;
D、戊是碳酸钠,在碳酸钠溶液中,CO32-离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,故D错误.
故选C.
点评:本题为推断题,做题时注意找出题目的突破口是做该题的关键,结合元素化合物知识解答,注意盐类的水解问题.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案