
【题目】异戊烷的一氯代物有____种;正丁烷的二氯代物有____种。
【答案】4 6
【解析】
先写出异戊烷结构简式,看异戊烷分子中有几种不同位置的H原子,就可以得到几种一氯代物;对于正丁烷先写出其结构简式,确定分子中有几种不同位置的H原子,就可以得到几种一氯取代产物,然后再用Cl原子取代每种位置上的H原子,就会得到其二氯取代产物;
异戊烷结构简式为![]() ,由于
,由于![]() 上连接2个—CH3和1个—CH2CH3,2个甲基上的6个H原子为等效H原子,所以分子中有4种不同位置的H原子,因此异戊烷有四种一氯代物;正丁烷结构简式为CH3CH2CH2CH3,分子中含有2种不同位置的H原子,所以一氯取代产物有两种,分别是CH3CH2CH2CH2Cl,CH3CH2CHClCH3;二氯取代产物中,2个Cl原子可以在同一个C原子上,也可以在两个不同的C原子上;则其对应的二氯取代产物有:CH3CH2CH2CHCl2、CH3CH2CCl2CH3、CH3CH2CHClCH2Cl、CH3CHClCH2CH2Cl、CH2ClCH2CH2CH2Cl、CH3CHClCHClCH3,所以共有6种不同位置的二氯代物。
上连接2个—CH3和1个—CH2CH3,2个甲基上的6个H原子为等效H原子,所以分子中有4种不同位置的H原子,因此异戊烷有四种一氯代物;正丁烷结构简式为CH3CH2CH2CH3,分子中含有2种不同位置的H原子,所以一氯取代产物有两种,分别是CH3CH2CH2CH2Cl,CH3CH2CHClCH3;二氯取代产物中,2个Cl原子可以在同一个C原子上,也可以在两个不同的C原子上;则其对应的二氯取代产物有:CH3CH2CH2CHCl2、CH3CH2CCl2CH3、CH3CH2CHClCH2Cl、CH3CHClCH2CH2Cl、CH2ClCH2CH2CH2Cl、CH3CHClCHClCH3,所以共有6种不同位置的二氯代物。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),工艺流程如图:

i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为CrO42-。
ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值
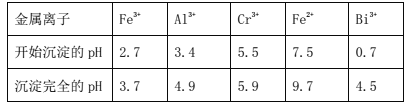
(1)步骤①提高酸溶速率的措施__(任填一条即可)。固体A的成分是___。
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为__,目的是__。
(3)写出④反应的离子方程式__。
(4)将溶液H经过__即得红矾钠粗晶体。
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:

(5)第①步反应的离子方程式是__。
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为___mol/L(101/2≈3.2)。
(7)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为__g(已知FeSO4·7H2O的摩尔质量为278g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法中正确的是( )
A.标准状况下,22.4 L 甲苯所含的分子数约为NA
B.室温下,2.8g 乙烯与丙烯的混合物中含碳原子的数目为 0.2NA
C.1 mol C3H8 分子中含有共价键的数目为 9 NA
D.1 mol 氯气和足量甲烷在光照条件下反应可生成 2 NA 个氯化氢分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1C时,向固定体积密闭容器中通入2mol SO2和1molO2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)+197 kJ一段时间后,将反应体系温度瞬间升至T2C,并开始连续测定体系内SO3的物质的量浓度并绘制其与时间t的变化关系示意图。下列示意图一定不可能出现的是( )
2SO3(g)+197 kJ一段时间后,将反应体系温度瞬间升至T2C,并开始连续测定体系内SO3的物质的量浓度并绘制其与时间t的变化关系示意图。下列示意图一定不可能出现的是( )
A.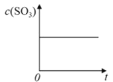 B.
B.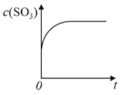 C.
C.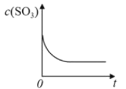 D.
D.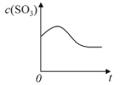
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物具有抗癌抑菌活性,其结构如图所示,下列关于该有机物说法正确的是( )
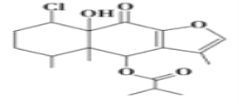
A.该有机物可以使溴水、酸性高锰酸钾溶液褪色,遇FeCl3溶液会显紫色
B.该有机物结构中含5个手性碳原子
C.1mol该有机物最多和4molH2反应
D.1mol该有机物最多消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法正确的是( )
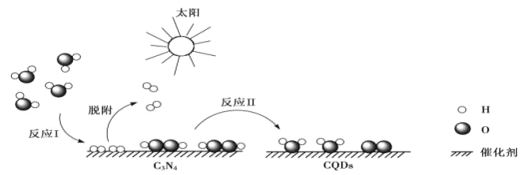
A.H2O2中存在非极性共价键,是非极性分子
B.反应Ⅰ中涉及到极性键的断裂和非极性键的形成
C.非极性分子中一定有非极性键,极性分子中一定有极性键
D.H2O由于存在分子间氢键而稳定性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某浓度H2A溶液中滴加NaOH溶液,若定义pC=﹣lgC,则测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是( )
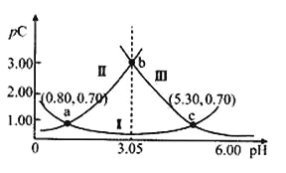
A.曲线II表示pC(HA-)随pH的变化
B.常温下,![]() =104.50
=104.50
C.将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
D.a、b、c三点对应的溶液,c(HA-)+c(A2-)+c(HA)始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
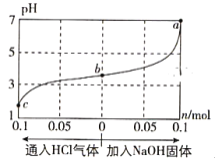
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com