
【题目】在一个体积为5 L的真空密闭容器中加入1.25 mol CaCO3,发生反应CaCO3 (s)![]() CaO(s) +CO2(g),测得平衡时二氧化碳的物质的量浓度随温度的变化关系如图所示:
CaO(s) +CO2(g),测得平衡时二氧化碳的物质的量浓度随温度的变化关系如图所示:

请按要求回答下列问题:
(1)该反应正反应为__________热反应(填“吸”或“放”),温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平均反应速率为________________。
(2)T2℃时,该反应已经达到平衡,下列措施中能使该反应的平衡常数K值变大的是_______________(选填编号)。
a.减小压强 b.减少CaO的量 c.加入CaCO3 d.升高温度
(3)请在如图中画出平衡常数K随温度的变化曲线_______________。
(4)在T5℃下,维持温度和容器体积不变,向上述平衡体系中再充入1molN2,则最后平衡时容器中的CaCO3的质量为________g。
【答案】 吸 0.005 mol. L-1 s-1 d 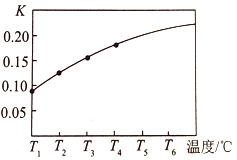 25
25
【解析】1)温度越高,二氧化碳的物质的量浓度越大,此反应为吸热反应,T5℃时二氧化碳的物质的量浓度为0.2mol/L,v(CO2)=c(CO2)/△t=0.2mol/L/40s=0.005mol/(Ls);(2)CaCO3 (s)![]() CaO(s) +CO2(g),此反应特点为吸热的反应,K只与温度有关,升高温度,平衡右移,K值增大,答案选d;(3)温度越高,平衡常数越大,且平衡常数即为二氧化碳的浓度,故图象走势为上升,如图为
CaO(s) +CO2(g),此反应特点为吸热的反应,K只与温度有关,升高温度,平衡右移,K值增大,答案选d;(3)温度越高,平衡常数越大,且平衡常数即为二氧化碳的浓度,故图象走势为上升,如图为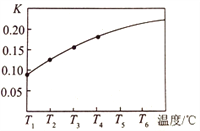 ;(4)维持温度和容器体积不变,向上述平衡体系中再充入1molN2,对此平衡无影响,故生成二氧化碳的浓度仍然为0.2mol/L,体积为5L,那么物质的量为5L×0.2mol/L=1mol,依据反应:
;(4)维持温度和容器体积不变,向上述平衡体系中再充入1molN2,对此平衡无影响,故生成二氧化碳的浓度仍然为0.2mol/L,体积为5L,那么物质的量为5L×0.2mol/L=1mol,依据反应:
CaCO3 (s)![]() CaO(s) +CO2(g)
CaO(s) +CO2(g)
100 44
x 44g
解x=100g,那么剩余碳酸钙质量为125g-100g=25g。


科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)![]() 2Z(g) 一定达到化学平衡状态的是( )
2Z(g) 一定达到化学平衡状态的是( )
①容器中气体的密度不再发生变化 ② X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①②B.②③C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)
4NO(g)+6H2O(g);△H=-905k/mol,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是
2N2(g)+6H2O(g);△H=-1268kj/mol。下列说法正确的是

A. 工业上进行氨催化氧化生成NO时,温度应控制在780~840℃之间
B. 工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率
C. 在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率
D. 氮气氧化为NO的热化学方程式为:N2(g)+O2(g)![]() 2NO(g)△H=-181.5kJ/mol
2NO(g)△H=-181.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律指出:化学反应的焓变只与各反应物的始态和各生成物的终态有关,而与具体的反应途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )(A→F从△H1递增到△H6)
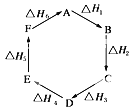
A. A→F △H=-△H6 B. △H1+△H2+△H3+△H4+△H5+△H6=1
C. C→F ∣△H∣=∣△H1+△H2+△H6∣ D. ∣△H1+△H2+△H3∣=∣△H4+△H5+△H6∣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-801.3kJ/mol 结论:CH4的燃烧热为801.3kJ/mol
B. Sn(s,灰) ![]() Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
Sn(s,白) ΔH=+2.1kJ/mol(灰锡为粉末状)结论:锡制品在寒冷的冬天因易转化为灰锡而损坏
C. 稀溶液中有:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol结论:将盐酸与氨水的稀溶液混合后,若生成1mol H2O,则会放出57.3kJ的能量
D. C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1C(s,金刚石)+O2(g)=CO2(g) ΔH=-395kJ·mol-1 结论:相同条件下金刚石性质比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯甲烷(CH3Cl)一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等有机浓剂。
(1)甲组同学在实验室用装置A模拟催化法制备一氯甲烷并检验CH3Cl的稳定性。
A.  B.
B.  C.
C. 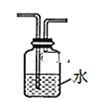 D.
D. 
①装置A中仪器a的名称为__________,a瓶中发生反应的化学方程式为________。
②实验室干燥ZnCl2晶体制备无水ZnCl2的方法是________。
(2)为探究CH3Cl与CH4分子稳定性的差别,乙组同学设计实验验证CH3C1能被酸性KMnO4溶液氧化。
①为达到实验目的,上面装置图中装置连接的合理顺序为A________
②装置中水的主要作用是__________。
③若实验过程中还产生了一种黄绿色气体和一种无色气体,该反应的离子方程式为_____。
(3)丙组同学选用A装置设计实验探究甲醇的转化率。取6.4g甲醇与足量的浓盐酸充分反应,将收集到的CH3Cl气体在足量的氧气中充分燃烧,产物用过量的V1mL、c1mol·L-1NaOH溶液充分吸收。现以甲基橙作指示剂,用c2mol·L-1盐酸标准溶液对吸收液进行返滴定,最终消耗V2mL盐酸。(已知:2CH3Cl+3O2![]() 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
①滴定终点的现象为____________
②该反应甲醇的转化率为________。(用含有V、c的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]()
![]()
![]()
![]() 。一定条件下,向容积为
。一定条件下,向容积为![]() 的密闭容器中充入
的密闭容器中充入![]() 和
和![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化的曲线如图所示。下列叙述中正确的是( )
的浓度随时间变化的曲线如图所示。下列叙述中正确的是( )

A.升高温度能使 增大
增大
B.反应达到化学平衡时,![]() 的转化率为75%
的转化率为75%
C.![]() 时,用
时,用![]() 表示的正反应的反应速率等于用
表示的正反应的反应速率等于用![]() 表示的逆反应的反应速率
表示的逆反应的反应速率
D.从反应开始到反应达到平衡状态,![]() 的平均反应速率
的平均反应速率![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是( )

A.在温度、体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为92kJ
B.a曲线是加入催化剂时的能量变化曲线,催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
C.催化剂,能增大有效碰撞次数,但不能提高N2的转化率
D.该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -92kJ/mol
2NH3(g) △H= -92kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的电池反应为:![]()
![]()
![]()
![]() 下列说法正确的是
下列说法正确的是
A.放电时,正极的反应式是:![]()
B.放电时,电解质溶液中的H+向负极移动
C.充电时,阳极的电极反应为:![]()
D.充电时,当有20.7gPb生成时,转移的电子为0.1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com