
| A. | 混合气体的密度不再发生变化 | B. | 混合气体的颜色不再发生变化 | ||
| C. | 反应放出的热量恰好为9.4kJ时 | D. | 混合气体的压强不再发生变化 |
分析 当可逆反应中正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变时该反应达到平衡状态.
解答 解:A.恒容条件下,气体的体积不变,反应前后混合气体的质量不变,所以混合气体的密度始终不变,则不能根据混合气体密度判断平衡状态,故A错误;
B.该反应中只有碘有颜色,反应前后碘的浓度减小,当碘的浓度不变时该反应达到平衡状态,所以混合气体的颜色不再发生变化时该反应达到平衡状态,故B正确;
C.反应放出的热量恰好为9.4kJ时该反应不一定达到平衡状态,与反应物的量有关,所以不能据此判断平衡状态,故C错误;
D.反应前后气体的计量数之和不变,所以无论是否达到平衡状态,混合气体的压强都不变,所以不能根据压强判断平衡状态,故D错误;
故选B.
点评 本题考查化学平衡状态判断依据,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
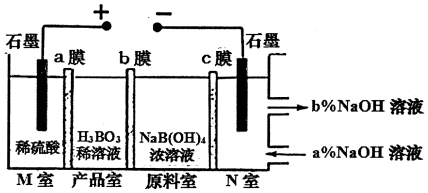
| A. | M室发生的电极反应式:2H2O-4e-═O2↑+4H+ | |
| B. | N室:a%<b% | |
| C. | 产品室发生的反应是:B(OH)4-+H+?H3BO3+H2O | |
| D. | 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| B. | 煤的干馏、煤的汽化和煤的液化都属于化学变化 | |
| C. | 自来水厂用明矾净水,用Fe2(SO4)3或ClO2代替明矾净水,其原理相同 | |
| D. | 将水中的铁闸门连接电源的负极而防腐,是外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 所选主要仪器(铁架台等忽略) | 部分操作 |
| A | 用浓硫酸配制480mL0.1mol/L硫酸溶液 | 500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管 | 将量取好的浓硫酸放入容量瓶中,加水溶解至刻度线 |
| B | 从食盐水中得到NaCl晶体 | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 当加热至大量固体出现时,停止加热,利用余热加热 |
| C | 分离甲醇和甘油的混合物 | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管 | 温度计水银球插入液液面以下 |
| D | 用CCl4萃取溴水中的Br2 | 分液漏斗、烧杯 | 分离时下层液体从分液漏斗下口放出,上层液体从上口倒出 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
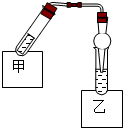 如图是乙酸乙酯制备的装置.在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上.
如图是乙酸乙酯制备的装置.在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 金属钠和水反应 | B. | 生石灰变成熟石灰的反应 | ||
| C. | Al和Fe2O3的铝热反应 | D. | CaCO3受热分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com