
| A. | 原子半径C>D>E | |
| B. | A2E6分子中各原子均满足8电子结构 | |
| C. | 气态氢化物的稳定性HmE>HnD | |
| D. | B、C形成的化合物中只可能存在离子键 |
分析 A、B、C、D、E是元素周期表中前18号元素,原子序数依次增大,已知B、D同主族,形成共价化合物DB3,则B为O元素、D为S元素,C、D、E同周期,可组成离子化合物C2B,则C为Na,E的原子序数最大,则E为Cl,元素形成共价化合物AE4,A的原子序数小于氧,则A为碳元素,据此解答.
解答 解:A、B、C、D、E是元素周期表中前18号元素,原子序数依次增大,已知B、D同主族,形成共价化合物DB3,则B为O元素、D为S元素,C、D、E同周期,可组成离子化合物C2B,则C为Na,E的原子序数最大,则E为Cl,元素形成共价化合物AE4,A的原子序数小于氧,则A为碳元素.
A.同周期自左而右原子半径减小,故原子半径Na>S>Cl,故A正确;
B.C2Cl6分子中各原子均满足8电子结构,故B正确;
C.非金属性Cl>S,故氢化物稳定性HCl>H2S,故C正确;
D.钠与氧形成的过氧化钠中既存在离子键又存在共价键,故D错误,
故选:D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意掌握常见元素化合物组成.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
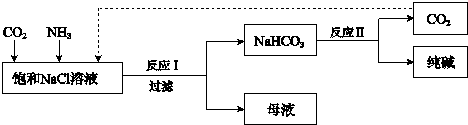
 2NH3.
2NH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.6mol | C. | 0.8mol | D. | l.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
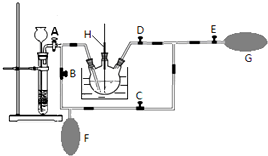
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
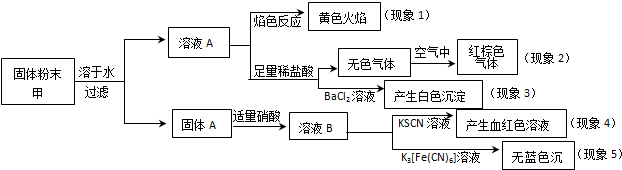
| A. | 根据现象1可推出该固体粉末中含有钠元素,但一定不含钾元素 | |
| B. | 根据现象2可推出该固体粉末中一定不含有NaNO2 | |
| C. | 根据现象3可推出该固体粉末中一定含有Na2SO4 | |
| D. | 根据现象4和现象5可推出该固体粉末中一定不含FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
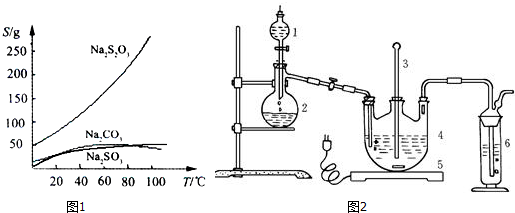

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应物的键能总和比生成物的键能总和高 | |
| B. | E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | |
| C. | 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应 | |
| D. | 使用合适的催化剂能同时降低E1和E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
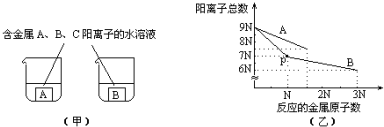
| A. | ① | B. | ② | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
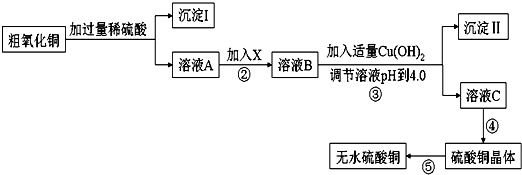
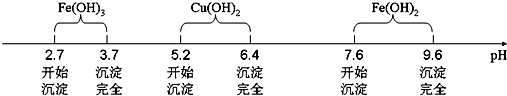
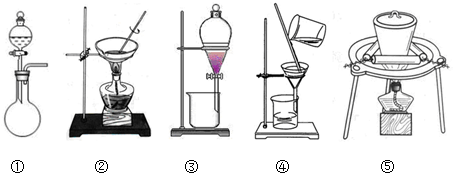
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com