
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量![]() N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
(1)写出该反应的热化学方程式________________。
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=a kJ·mol1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=c kJ·mol1
2H2(g)+O2 (g)═2H2O(l)△H=d kJ·mol1 (abcd均为正值)
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量。
②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量。
③b 与a、c、d的数学关系式是_____________。
【答案】N2H4(1)+2H2O2(1)=N2(g)+4H2O(g) △H=640kJ/mol 408 等于 小于 b=![]() a
a
【解析】
(1)已知0.4mol液态肼和足量H2O2(l)反应生成氮气和水蒸气时放出256.64kJ的热量,依据热化学方程式的书写原则,结合定量关系写出,1mol肼和过氧化氢反应生成氮气和水蒸气放出的热量=![]() =640 kJ,所以热化学方程式为 N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=640kJ/mol;
=640 kJ,所以热化学方程式为 N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=640kJ/mol;
答案:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=640kJ/mol;
(2)16g液态肼物质的量=![]() =0.5mol,由①N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=641.6kJ/mol;②H2O(1)=H2O(g)△H=+44kJ/mol,结合盖斯定律,可以把②×4方向倒转得到③4H2O(g)=4H2O(l)△H=44×4kJ/mol=176kJ/mol,①+③得到N2H4(1)+2H2O2(1)=N2(g)+4H2O(l) △H=816kJ/mol,所以0.5mol液态肼与足量双氧水反应生成氮气和液态水时,放出的热量=
=0.5mol,由①N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=641.6kJ/mol;②H2O(1)=H2O(g)△H=+44kJ/mol,结合盖斯定律,可以把②×4方向倒转得到③4H2O(g)=4H2O(l)△H=44×4kJ/mol=176kJ/mol,①+③得到N2H4(1)+2H2O2(1)=N2(g)+4H2O(l) △H=816kJ/mol,所以0.5mol液态肼与足量双氧水反应生成氮气和液态水时,放出的热量=![]() =408kJ;
=408kJ;
故答案为:408;
(3)①根据盖斯定律,煤作为燃料不管是一步完成还是分两步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样;
故答案为:等于;
②该反应属于吸热反应,因此反应物具有的总能量小于生成物的总能量;
故答案为:小于;
③ C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=a kJ·mol1 ①
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=c kJ·mol1 ②
2H2(g)+O2 (g)═2H2O(l)△H=d kJ·mol1 ③
根据盖斯定律:①②/2③/2得C3H8(g)═C3H6(g)+H2(g)△H=![]() +
+![]() a kJ·mol1再根据已知可得b=
a kJ·mol1再根据已知可得b=![]() +
+![]() a;
a;
故答案为:b=a


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A. 饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
B. 25℃时,FeS的溶解度大于CuS的溶解度
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D. 向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是
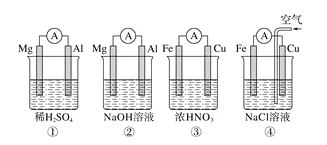
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为![]()
C.③中Fe作负极,电极反应式为![]()
D.④中Cu作正极,电极反应式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
已知:N2H4·H2O高温易分解,易氧化
制备原理:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
(实验一) 制备NaClO溶液(实验装置如图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有_____(填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是_____________________________。
(实验二) 制取水合肼。(实验装置如图所示)
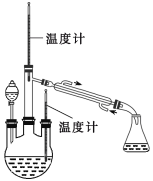
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114馏分。
(3)分液漏斗中的溶液是____________(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________。蒸馏时需要减压,原因是______________。
(实验三) 测定馏分中肼含量。
(4)水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体(保证滴定过程中溶液的pH保持在6.5左右),配制1000mL溶液。
b.移取10.00 mL于锥形瓶中,加入10mL水,摇匀。
c.用0.2000mol/L碘溶液滴定至溶液出现______________,记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(5)滴定时,碘的标准溶液盛放在______________滴定管中(选填:“酸式”或“碱式”)水合肼与碘溶液反应的化学方程式________________________。
(6)若本次滴定消耗碘的标准溶液为8.20mL,馏分中水合肼(N2H4·H2O)的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、M、Y、Z是元素周期表前四周期的六种元素,原子序数依次递增。已知:
①Z位于ds区,最外能层没有单电子,其余的均为短周期主族元素;
②Y原子价电子排布为msnmpn(m≠n);
③M的基态原子2p能级有1个单电子;
④Q、X原子p轨道的未成对电子数都是2。
用化学术语回答下列问题:
(1)Z在周期表中的位置______________。
(2)Q、R、X、M四种元素第一电离能由大到小的顺序为__________ (用对应元素的符号填写)。
(3)X、M两元素形成的化合物XM2的VSEPR模型名称为_________,已知XM2分子的极性比水分子的极性弱,其原因是__________________。
(4)分析下表中两种物质的键能数据(单位:kJ/mol)。
A—B | A=B | A≡B | |
QX | 357.7 | 798.9 | 1 071.9 |
R2 | 154.8 | 418.4 | 941.7 |
①结合数据说明QX比R2活泼的原因:________________________。
②QX与R2互为等电子体,QX的结构式为(若有配位键请用→表示)______。Fe易与QX形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,则此配合物化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
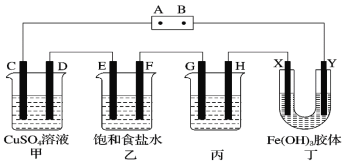
(1)电源A极的名称是________。
(2)甲装置中电解反应的总化学方程式为(电解质溶液是足量的):_______电解后若使电解质溶液复原需要加入适量的__________________
(3)如果收集乙装置中产生的气体,两种气体的体积比是(忽略气体的溶解)________。ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。若调控合适的电压可以利用乙装置制备ClO2,写出阳极产生ClO2的电极反应式__________ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂污水中含CN-,现用ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:_____________。
(4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要成分是________(填化学式)。
(5)装置丁中的现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:①工作一段时间后A槽pH值上升,B槽的pH下降。②b、c两极上反应的离子的物质的量相等。应选择的电解质是( )

A.A槽NaOH溶液;B槽CuSO4溶液
B.A槽AgNO3溶液;B槽CuCl2溶液
C.A槽Na2SO4溶液;B槽AgNO3溶液
D.A槽NaCl溶液;B槽AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的装置和其他必要的仪器用品,完成下列实验。

已知2NH3+3CuO![]() N2+3Cu+3H2O,该实验证明氨气具有还原性。
N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是______________,倒扣漏斗的作用是___________________。
(2)浓氨水与固体NaOH接触,会逸出大量氨气原因是______________________。
(3)硬质玻璃管中可观察到的实验现象是_________________________________。
(4)常温下,若氨水与稀硫酸恰好完全中和,则所得溶液中各离子浓度的大小顺序为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJmol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJmol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJmol-1
则反应2N2O(g)=2N2(g)+O2(g) △H=_______ kJmol-1
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如下图

①已知T2>T1,则反应2NO(g)+2CO(g)![]() 2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有____(填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=____,该温度下用分压表示的平衡常数Kp= ___MPa-1(分压=总压×物质的量分数)。
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中____点。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。

①在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是____。
②当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com