
【题目】某兴趣小组以乙烯等为主要原料合成药物普鲁卡因:
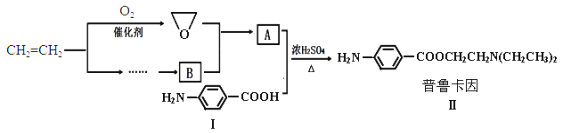
已知:![]() ,
,![]()
(1)对于普鲁卡因,下列说法正确的是___。
a.一个分子中有11个碳原子
b.不与氢气发生加成反应
c.可发生水解反应
(2)化合物Ⅰ的分子式为___,1mol化合物Ⅰ能与___molH2恰好完全反应。
(3)化合物Ⅰ在浓H2SO4和加热的条件下,自身能反应生成高分子聚合物Ⅲ,写出Ⅲ的结构简式___。
(4)请用化学反应方程式表示以乙烯为原料制备B(无机试剂任选)的有关反应,并指出所属的反应类型___。
【答案】C C7H7NO2 3 ![]() 或
或![]() CH2=CH2+HCl
CH2=CH2+HCl![]() CH3CH2Cl,加成反应;2CH3CH2Cl+NH3→HN(CH2CH3)2+2HCl,取代反应
CH3CH2Cl,加成反应;2CH3CH2Cl+NH3→HN(CH2CH3)2+2HCl,取代反应
【解析】
由普鲁卡因、对氨基苯甲酸的结构,可知A为HOCH2CH2N(CH2CH3)2,B应为(CH2CH3)2NH。
(1)A.由结构可知,普鲁卡因分子含有13个碳原子,A错误;
B.含有苯环,能与氢气发生加成反应,B错误;
C.含有酯基,可以发生水解反应,C正确,故答案为:C;
(2)根据化合物Ⅰ的结构简式,可知其分子式为C7H7NO2,苯环与氢气发生加成反应,1mol化合物I能与3mol氢气发生加成反应,故答案为:C7H7NO2;3;
(3)化合物Ⅰ含有羧基、氨基,发生缩聚反应生成高聚物,则高聚物结构简式为![]() ,故答案为:
,故答案为:![]() 或
或![]() ;
;
(4)结合信息可知,乙烯与HCl发生加成反应生成CH3CH2Cl,CH3CH2Cl再与氨气发生取代反应生成HN(CH2CH3)2,反应方程式为:CH2=CH2+HCl![]() CH3CH2Cl,2CH3CH2Cl+NH3→HN(CH2CH3)2+2HCl,故答案为:CH2=CH2+HCl
CH3CH2Cl,2CH3CH2Cl+NH3→HN(CH2CH3)2+2HCl,故答案为:CH2=CH2+HCl![]()
CH3CH2Cl,加成反应、2CH3CH2Cl+NH3→HN(CH2CH3)2+2HCl ,取代反应。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】方法与规律提炼:
(1)某同学利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,设计的装置如下图所示。
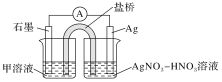
为达到目的,其中石墨为_________极,甲溶液是____________,证明反应Ag++Fe2+=Ag+Fe3+能够发生的实验操作及现象是_________________________
(2)用零价铁(Fe)去除水体中的硝酸盐(NO![]() )已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如图所示。
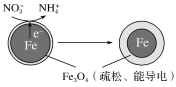
上图中作负极的物质是___________。正极的电极反应式是______________。
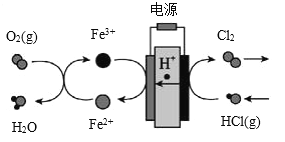
(3)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:阴极区的电极反应式为_______________。 电路中转移1 mol电子,需消耗氧气_______L(标准状况)。
(4)KClO3也可采用“电解法”制备,装置如图所示。
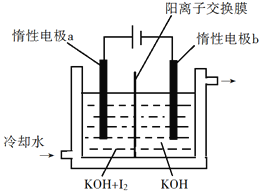
写出电解时阴极的电极反应式___________________电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________(填a→b或b→a)。
学法题:通过此题的解答,请归纳总结书写电极反应式的方法____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是与硫同主族的元素。
已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O→Se+2SO42-+4H+
(1)通过以上反应判断SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是___。
工业上回收得到的SeO2样品混有其它杂质,可以通过下面的方法测定SeO2含量:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
(2)配平反应式①,标出电子转移的方向和数目___。
(3)实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为___。
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(4)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是___溶液;各取5mL上述溶液,分别加热(温度相同),pH较小的是___溶液。
(5)取5mLNH4Cl溶液,加水稀释至50mL,c(H+)___10-6mol/L(填“>”、“<”或“=”),![]() ___填“增大”、“减小”或“不变”)。
___填“增大”、“减小”或“不变”)。
(6)向等物质的量浓度的Na2S、NaOH混合溶液中滴加稀盐酸。
①在滴加盐酸过程中,溶液中c(Na+)与含硫各物种浓度的大小关系为___(选填字母)。
a.c(Na+)=c(H2S)+c(HS-)+2c(S2-) b.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
c.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)] d.2c(Na+)=c(H2S)+c(HS-)+2c(S2-)
②NaHS溶液呈碱性,若向溶液中加入CuSO4溶液,恰好完全反应,所得溶液呈强酸性,其原因是___(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知葡萄糖(C6H12O6)的燃烧热是2804kJ·mol-1,当它在人体内氧化生成1g水时放出的热量约为( )
A.26.0kJB.51.9kJC.155.8kJD.467.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是重要的科学研究方法,下列物质分类正确的是
A.酸性氧化物:SO2、SiO2、NO2
B.弱电解质:CH3COOH、BaCO3、Fe(OH)3
C.纯净物:铝热剂、漂粉精、聚乙烯
D.无机物:CaC2、石墨烯、HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关盐类水解的相关描述中,不正确的是( )
A.中国古代利用明矾溶液清除铜镜表面的铜锈
B.![]() 溶液中:
溶液中:![]()
C.0.1 mol/L.醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后的溶液中:![]()
D.物质的量浓度相等的①![]() ;②
;②![]() ;③
;③![]() 三种溶液中,pH值由大到小的顺序为②>③>①
三种溶液中,pH值由大到小的顺序为②>③>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、![]() )中回收氧化铁流程如图所示:
)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式: _________,指出使用空气比使用氯气好的原因是__________。
(2)已知Fe3+(aq)+3OH-(aq)=Fe(OH)3(s) ΔH=-Q1 kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上Fe3+在该溶液中可存在的最大浓度c(Fe3+)=____________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是________(填化学式,下同),用________试剂可将其除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com