
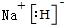 ;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.
;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.分析 X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,则X为H元素.X与R的最外层电子数相等,二者原子序数相差大于2,故R为Na,可知Z、Q处于第二周期,Z的内层电子数是最外层电子数的一半,Z的原子最外层电子数为4,故Z为碳元素;U的最高化合价和最低化合物的代数和为6,则U为Cl,R和Q可形原子数之比为1:1和2:1的两种化合物,则Q为O元素,R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应,可推知T为Al.
(1)T为Al,元素在期表中的位置是第三周期ⅢA族,由上述元素中的四种元素形成的既含有离子键又含有共价键的化学物为碳酸氢钠、醋酸钠、四羟基合铝酸钠等;
(2)同周期自左而右原子半径减小,所有元素中H原子半径最小;
(3)T、U两元素最高价氧化物对应的水化物分别为Al(OH)3、HClO4,二者发生中和反应;
(4)物理性质不能比较金属性强弱,金属性强弱与失去电子数目多少无关,与失去电子难易程度有关,可以根据金属与水或酸反应难易、剧烈程度以及最高价氧化物的水化物的碱性强弱比较;
(5)计算生成3.6kg水时放出的热量,再结合能量转化率计算,注意1kW.h=3600kJ;
(6)①RX为NaH,由于钠离子与氢负离子构成,NaH与H2O反应生成氢氧化钠与氢气;
②如果有Na残留,Na与水反应也生成氢气.
解答 解:X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,则X为H元素.X与R的最外层电子数相等,二者原子序数相差大于2,故R为Na,可知Z、Q处于第二周期,Z的内层电子数是最外层电子数的一半,Z的原子最外层电子数为4,故Z为碳元素;U的最高化合价和最低化合物的代数和为6,则U为Cl,R和Q可形原子数之比为1:1和2:1的两种化合物,则Q为O元素,R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应,可推知T为Al.
(1)T为Al,元素在期表中的位置是第三周期ⅢA族,由上述元素中的四种元素形成的既含有离子键又含有共价键的化学物为碳酸氢钠、醋酸钠、四羟基合铝酸钠等,
故答案为:第三周期ⅢA族;碳酸氢钠、醋酸钠、四羟基合铝酸钠等;
(2)同周期自左而右原子半径减小,所有元素中H原子半径最小,故原子半径:H<O<C,
故答案为:H<O<C;
(3)T、U两元素最高价氧化物对应的水化物分别为Al(OH)3、HClO4,反应的化学方程式为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O,
故答案为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O;
(4)a.单质的熔点属于物理性质,不能判断金属性强弱,故a错误;
b.金属性强弱与失去电子数目多少无关,与失去电子难易程度有关,故b错误;
c.金属性越强,单质与水反应越剧烈,故c正确;
d.金属性越强,最高价氧化物的水化物的碱性越强,
故选:cd;
(5)氢气、氧气两单质组成的燃料电池每生成1mol液态水放出286KJ的能量,当该电池工作生成3.6kg水时,生成水的物质的量为$\frac{3600g}{18g/mol}$=200mol,则放出的热量为286kJ×20=57200kJ,电池产生的电能为 57200kJ×60%=34320kJ,而1kW.h=3600kJ,故电池产生的电能为$\frac{34320}{3600}$=9.5KW•h,
故答案为:9.5;
(6)①RX为NaH,电子式为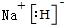 ,NaH与H2O反应的化学方程式为:NaH+H2O=NaOH+H2↑,
,NaH与H2O反应的化学方程式为:NaH+H2O=NaOH+H2↑,
故答案为: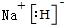 ;NaH+H2O=NaOH+H2↑;
;NaH+H2O=NaOH+H2↑;
②如果有Na残留,Na与水反应也生成氢气,该同学的说法不合理,
故答案为:不合理,如果有Na残留,Na与水反应也生成氢气.
点评 本题考查结构性质位置关系综合运用,熟练掌握基础知识并灵活运用,注意金属性、非金属性强弱比较实验事实,要注意金属氢化物有关问题.


科目:高中化学 来源: 题型:解答题
 有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.
有机物之间的反应通常比较复杂,同样的反应物在不同条件下生成不同的产物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 石灰石分解反应 | ||
| C. | NaOH溶液与盐酸反应 | D. | 甲烷与O2的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 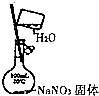 配置一定物质的量 浓度的NaNO3溶液 | |
| B. | 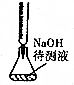 中和滴定 | |
| C. | 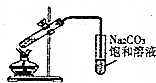 制备乙酸乙酯 | |
| D. | 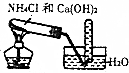 实验室制取氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
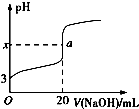 某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z等四种短周期元素组成,其中W的原子半径最小.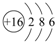 ;X和Y的原子半径N>O(填元素符号)
;X和Y的原子半径N>O(填元素符号)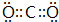 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com