
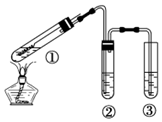
| A. | ②中选用品红溶液验证SO2的生成 | |
| B. | ③中选用NaOH溶液吸收多余的SO2 | |
| C. | 为确认有CuSO4生成,向①中加水,观察颜色 | |
| D. | 上下移动①中铜丝可控制SO2的产生与停止 |
分析 A.品红能被二氧化硫漂白,根据SO2的漂白性分析;
B.SO2为酸性氧化物,可与碱发生反应;
C.不应将水加入过量的浓硫酸中,否则易产生暴沸现象;
D.在加热的条件下,当铜丝与浓硫酸接触时才能反应.
解答 解:A.SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,故A正确;
B.SO2为酸性气体,具有污染性,可与碱发生反应,生成亚硫酸钠和水,可用NaOH溶液吸收多余的SO2,故B正确;
C.实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中还含有过量的浓硫酸,为确认CuS04生成,应用胶头滴管将试管1中的液体取出少量,滴入水中,观察溶液颜色,若溶液显蓝色,证明有硫酸铜生成,反之则无,而不应将水加入过量的浓硫酸中,否则易产生暴沸现象,故C错误;
D.在加热的条件下,当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故D正确;
故选C.
点评 本题考查了二氧化硫的性质,题目难度不大,注意二氧化硫的酸性和漂白性.


科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:B>A>C>D | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 四种元素一定都属于短周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-O | O=O | N≡N | N-H |
| 键能KJ•mol-1 | 463 | 496 | 942 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | A、B、E对应原子的第一电离能大小为:E>A>B | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与H2化合时X单质比Y单质容易 | |
| B. | X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 | |
| C. | 在氧化还原反应中,甲失的电子比乙多 | |
| D. | X单质可以把Y从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
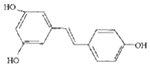 ,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )| A. | 1mol,1mol | B. | 3.5mol,7mol | C. | 3.5mol,6mol | D. | 6mol,7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X、Z、W各自最高和最低化合价的代数和分别为1、4、6 | |
| B. | 原子半径的大小为Y>Z>W | |
| C. | 元素的非金属性顺序为W>Z>X | |
| D. | Y和其他3种元素均能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数A>B | B. | 核外电子数为B>A | C. | 原子半径A>B | D. | 离子半径 B2+>A- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验步骤 | 实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
| A. | 完成该实验需用到的实验仪器有试管和胶头滴管 | |
| B. | CCl4在实验中所起的作用是萃取剂 | |
| C. | ③中反应的离子方程式为Cl2+2I-═2Cl-+I2 | |
| D. | 上述三步实验能很好的探究卤素单质的氧化性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com