
| A. | 可能含有Ag+、Al3+、NH${\;}_{4}^{+}$ | |
| B. | 一定不含Cl-,可能含有NO${\;}_{3}^{-}$ | |
| C. | 一定不含AlO${\;}_{2}^{-}$、NH${\;}_{4}^{+}$、CO${\;}_{3}^{2-}$ | |
| D. | 可能含有Fe3+、Fe2+,一定不含AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$ |
分析 加入氢氧化钠溶液后,开始产生沉淀并逐渐增多,随后沉淀有逐渐减少,则溶液中一定含有Al3+,根据离子共存,溶液中一定不存在H+、AlO2-、CO32-;整个过程始终无气体放出,则一定不存在NH4+;Cl-、NO3-离子至少存在1种,若存在Cl-,一定不存在Ag+,若存在NO3-,可能存在Ag+、Fe3+、Fe2+,据此对各选项进行判断.
解答 解:加入氢氧化钠溶液后,开始产生沉淀并逐渐增多,随后沉淀有逐渐减少,则溶液中一定含有Al3+,根据离子共存,溶液中一定不存在H+、AlO2-、CO32-;整个过程始终无气体放出,则一定不存在NH4+;Cl-、NO3-离子至少存在1种,若存在Cl-,一定不存在Ag+,若存在NO3-,可能存在Ag+、Fe3+、Fe2+,
A.根据分析可知,一定存在Al3+,一定不存在NH4+,若不存在氯离子,可能存在Ag+,故A错误;
B.根据溶液电中性,溶液中Cl-、NO3-离子至少存在1种,无法确定是否含有Cl-,故B错误;
C.根据分析可知,溶液中一定不存在NH4+、AlO2-、CO32-,故C正确;
D.溶液中可能含有Fe3+、Fe2+,一定不存在AlO2-、CO32-,故D正确;
故选CD.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质及检验方法为解答关键,推断过程中注意严密性,排除干扰离子,试题侧重考查学生达到分析能力及逻辑推理能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 一溴代二甲苯 | 234℃ | 20℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
| 对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
| A. | 邻二甲苯 | B. | 间二甲苯 | C. | 对二甲苯 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
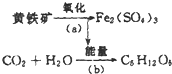 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4+2NaHCO3═2NaCl+2H2O+2CO2↑ | B. | 2HCl+BaS═BaCl2+H2S↑ | ||
| C. | CO2+H2O+Ca(ClO)2═CaCO3↓+2HClO | D. | H2S+CuSO4═CuS↓+H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氯甲烷有两种同分异构体 | |
| B. | 苯和苯的同系物均能使酸性高锰酸钾溶液褪色 | |
| C. | 用核磁共振氢谱不能鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 一定条件下,溴乙烷既能发生取代反应又能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的SO2 通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O | |
| C. | 硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com