
【题目】研究NO的性质对建设美丽家乡,打造宜居环境具有重要意义。
(1)自然界在闪电时,生成NO的反应方程式为__________________。
(2)T℃时在容积为2L的恒容密闭容器中,充入NO和O2发生反应:2NO(g)+O2(g)2NO2(g),不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①在T℃下,0~2s时,该反应的平均反应速率![]() =________;
=________;
②该温度下反应的平衡常数K=________,在T℃下,能提高NO的平衡转化率的措施有_______、________。
(3)已知NO和O2反应的历程如图,回答下列问题:
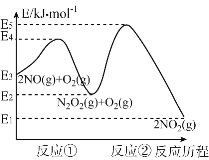
①写出其中反应①的热化学方程式也(△H用含物理量E的等式表示):________。
②试分析上述基元反应中,反应①和反应②的速率较小的是_____(选填“反应①”或“反应②”);已知反应①会快速建立平衡状态,反应②可近似认为不影响反应①的平衡。对该反应体系升高温度,发现总反应速率变慢,其原因可能是____________。
【答案】N2+O2![]() 2NO 0.15mol·L-1·s-1 160.0L·mol-1 增大O2的浓度 增大体系压强 2NO(g)
2NO 0.15mol·L-1·s-1 160.0L·mol-1 增大O2的浓度 增大体系压强 2NO(g)![]() N2O2(g) △H=-(E3-E2)kJ·mol-1 反应② 因为反应①为放热反应,升高温度,反应①平衡逆向移动,导致c(N2O2)减小,反应②变慢,而反应②为慢反应是总反应速率的决速反应
N2O2(g) △H=-(E3-E2)kJ·mol-1 反应② 因为反应①为放热反应,升高温度,反应①平衡逆向移动,导致c(N2O2)减小,反应②变慢,而反应②为慢反应是总反应速率的决速反应
【解析】
(2)根据![]() 计算化学反应速率;根据
计算化学反应速率;根据![]() 求算平衡常数;
求算平衡常数;
(3)根据△H=生成物的总能量-反应物的总能量求算△H;
(4)一般来说,活化能越大,化学反应速率越慢。
(1)在闪电时,N2和O2会发生化合反应生成NO,化学方程式为N2+O2![]() 2NO;
2NO;
(2)①在T℃下,0~2s时,n(NO)从1mol降低到0.4mol,变化了0.6mol,容器体积为2L。根据![]() ,带入数据,有
,带入数据,有![]() ;
;
②根据方程式,从开始到平衡,消耗n(NO)=1mol-0.2mol=0.8mol,则生成n(NO2)=0.8mol。平衡时,NO、O2、NO2的物质的量分别为0.2mol、0.2mol、0.8mol,容器体积为2L,平衡常数![]() ,带入数据,有
,带入数据,有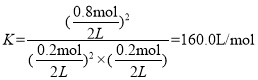 ;
;
在T℃下,提高NO的转化率,需平衡向正反应方向移动,需要注意的是,温度已经限定,不能改变温度。则增大NO的转化率,可以增大O2的浓度;该反应是气体分子数减小的反应,可以压缩体积,增大压强;
(3)①根据图像,反应①为NO(g)反应化合生成N2O2(g),根据△H=生成物的能量-反应物的能量,则热化学方程式:2NO(g)![]() N2O2(g) △H=-(E3-E2)kJ·mol-1;
N2O2(g) △H=-(E3-E2)kJ·mol-1;
②一般来说,活化能越大,化学反应速率越慢。反应①的活化能为E4-E3,反应②的活化能为E5-E2,根据图示,反应②的活化能大,化学反应速率较小;
化学反应速率慢的基元反应是总反应的决速步,反应②的活化能大,化学反应速率较小,是总反应的决速步。从图示看,反应①和②都是放热反应,升高温度,平衡均逆向移动,由于反应①快速达到平衡,则反应①的产物N2O2的浓度会减小,但对于反应②来说,c(N2O2)减小,会使得反应②的反应速率减小,而反应②是总反应的决速步,因此总反应速率变慢。答案:因为反应①为放热反应,升高温度,反应①平衡逆向移动,导致c(N2O2)减小,反应②变慢,而反应②为慢反应是总反应速率的决速反应。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】科学家利用电解NaB(OH)4溶液制备H3BO3的工作原理如下图。 下列说法中正确的是
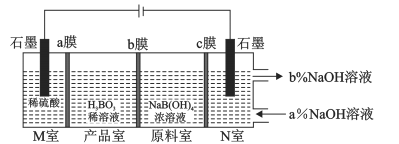
A.b膜为阳离子交换膜
B.N室中,进口和出口NaOH溶液的浓度:a%<b%
C.电子从左边石墨电极流出,先后经过a、b、c膜流向右边石墨电极
D.理论上每生成1molH3BO3,两极室共生成33.6L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰气的化学式为![]() ,结构式为
,结构式为![]() ,性质与卤素相似,下列有关叙述正确的是( )
,性质与卤素相似,下列有关叙述正确的是( )
A.氰气分子中既有极性键,又有非极性键
B.氰气分子中![]() 键的键长大于
键的键长大于![]() 键的键长
键的键长
C.氰气分子中含有2个![]() 键和4个
键和4个![]() 键
键
D.氰气不能和氢氧化钠溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图甲为晶体的二维平面示意图,所表示物质的化学式可能为AX2的是______(填“a”或“b”)。
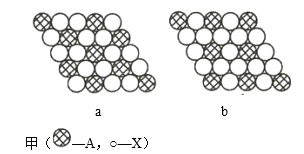
(2)图乙为金属铜的晶胞示意图,请回答下列问题。
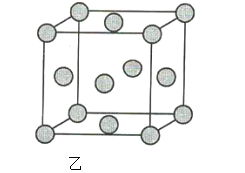
①该晶胞实际含有的铜原子数是______。
②该晶胞称为______(填序号)。
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞 D.简单立方晶胞
③该晶胞的边长为a cm, Cu的摩尔质量为64g·mol-1,金属铜的密度为pg·cm-3,则阿伏加德罗常数为___(用含a、p的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列四种晶体的晶胞示意图回答问题:
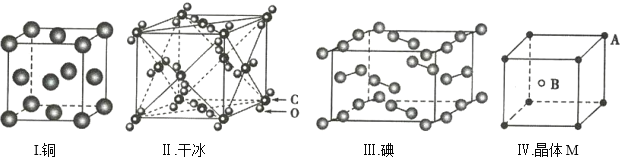
(1)根据图I分析,铜晶胞平均含有的铜原子数是___________。
(2)根据图Ⅱ分析,干冰晶胞平均含有的CO2分子数是___________。
(3)根据图Ⅲ分析,碘晶体中碘分子的排列有种不同的方向_________种不同的方向。
(4)根据图Ⅳ分析,晶体M的化学式可能是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌(ZnO)广泛用于橡胶、涂料、陶瓷、电子等行业,以粗氧化锌(主要成分为ZnO,还含有少量MnO、CuO、FeO、Fe2O3等)为原料经深度净化可制备高纯活性氧化锌,其流程如图所示:
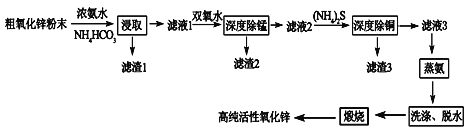
几种难溶物的Ksp:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 1.9×10-13 | 8.0×10-16 | 4.0×10-38 | 2.5×10-22 | 6.4×10-36 |
(1)将大小为66nm的高纯活性氧化锌粉末分散到水中,所得分散系为______。
(2)“浸取”过程中ZnO与NH3·H2O、NH4HCO3反应生成可溶性的Zn[(NH3)n]CO3和H2O。若有1mol ZnO溶解,则在该转化反应中参加反应的NH3·H2O和NH4HCO3物质的量之比的最大值为___________(已知:1≤n≤4)。
(3)“深度除锰”过程中双氧水可将“滤液1”中的Mn(OH)2转化为更难溶的MnO2·H2O,写出反应的化学方程式______________,“滤渣2”中存在的物质除了MnO2·H2O还可能含有_________(用化学式表示)。
(4)“深度除铜”过程中当溶液中![]() ≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
(5)“蒸氨”过程中Zn[(NH3)n]CO3分解为ZnCO3·2Zn(OH)2·H2O、NH3和CO2。为了提高经济效益,请设计循环利用NH3和CO2方案_____________。
(6)“煅烧”时ZnCO3·2Zn(OH)2转变为高纯活性氧化锌,写出反应的化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息,回答下列问题:
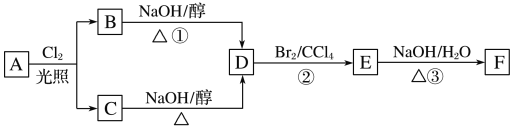
(1)标准状况下的气态烃A11.2L在氧气中充分燃烧可以产生66gCO2和36gH2O,则A分子式的是__________。
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为__________。
(3)D的结构简式为________________。
(4)E的一个同分异构体的结构简式是________。(写一个即可)
(5)①、②、③的反应类型依次是_______。
(6)写出③反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伞形酮可用作酸碱指示剂,可由雷琐苯乙酮和苹果酸在一定条件下反应制得。下列说法中错误的是
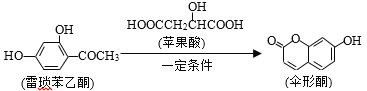
A.1mol伞形酮与足量NaOH溶液反应,最多可消耗3molNaOH
B.1 mol雷琐苯乙酮最多可与4 mol H2发生加成反应
C.苹果酸发生缩聚反应最多可生成2种高分子化合物
D.雷琐苯乙酮在一定条件下可发生氧化、取代、缩聚等反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com