
【题目】根据提供条件推断元素,并按要求填空:
(1)原子核外有3个电子层,其价电子数为7,最高价氧化物对应水化物化学式________,其单质与NaOH反应的化学方程式为_________________________。
(2) 已知X+、Y2+、Z—、W2—四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是_______________,原子半径由大到小的顺序是 。
(3)A+、B—、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++B—![]() C+D↑,则标出A+、B—的电子式 , ;比较C和D的稳定性的强弱大小 (用化学式表示)
C+D↑,则标出A+、B—的电子式 , ;比较C和D的稳定性的强弱大小 (用化学式表示)
(4) ①NH4NO3②NaF ③CO2④K2O2⑤NaOH ⑥CH4
只含有极性键的是________,既有离子键又有非极性键的是______;既有离子键又有极性键的是______.
【答案】(1) HClO4,Cl2+2NaOH===NaClO+NaCl+H2O;
(2)Y>X>Z>W,X>Y>W>Z
(3) ,
,![]() ,H2O>NH3;
,H2O>NH3;
(4)③⑥,④,①⑤ 。
【解析】试题分析:(1)价电子数为7,说明属于第VIIA族,有三个电子层,说明位于第三周期,即Cl,最高价氧化物对应水化物的化学式为HClO4,Cl2和NaOH反应,发生歧化反应,其化学反应方程式为:Cl2+2NaOH=NaClO+NaCl+H2O;(2)核外电子排布相同,说明阳离子在阴离子的下一周期,根据同周期化合价的排布规律,原子序数为Y>X>Z>W,原子半径是电子层数越多,半径越大,同周期从左向右半径减小,原子半径大小顺序是X>Y>W>Z;(3)都是10e-微粒,在加热分条件下,发生信息中的反应,NH4++OH-![]() NH3↑+H2O,其电子式分别为:
NH3↑+H2O,其电子式分别为: ,
,![]() ,同周期从左向右,非金属性增强,氢化物的稳定性增强,即H2O>NH3;(4)①既含有离子键和极性共价键;②只含有离子键;③只含有极性键;④含有离子键和非极性键;⑤含有离子键和极性共价键;⑥只含有极性键,③⑥,④,①⑤ 。
,同周期从左向右,非金属性增强,氢化物的稳定性增强,即H2O>NH3;(4)①既含有离子键和极性共价键;②只含有离子键;③只含有极性键;④含有离子键和非极性键;⑤含有离子键和极性共价键;⑥只含有极性键,③⑥,④,①⑤ 。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如下:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 molL-1 H2C2O4 溶液 | 30 mL 0.01 molL-1 KMnO4 酸性溶液 |
② | 20 mL 0.2 molL-1 H2C2O4 溶液 | 30 mL 0.01 molL-1 KMnO4 酸性溶液 |

(1)检验上图装置气密性的最简便方法为:____________。
(2)H2C2O4溶液与酸性 KMnO4溶液反应的化学方程式为____________。
(3)该实验探究的是___________因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是___________(填实验序号)。
(4)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________(若忽略溶液混合前后体积的变化)。
(5)小组同学发现反应速率总是如上右图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①__________、②_________、③K+对该反应有催化作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素aA、bB、cC、dD、eE的原子的结构示意图分别为
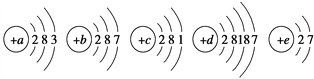
请回答下列问题:
(1)属于同周期的元素是__________(填元素符号,下同),属于同主族的元素__________。
(2)金属性最强的元素是__________,非金属性最强的元素是__________。
(3)上述元素中最高价氧化物对应的水化物碱性最强的是__________。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)该反应的化学方程式为____________________;
(2)反应开始至2min,以气体Z表示的平均反应速率为______________________;
(3)平衡时容器内混合气体密度比起始时__________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时___________;
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:
n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 _________。
2HI(g)达到平衡状态的是 _________。
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。
C(g)+D(g)达到平衡状态的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等。甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示。


图1 图2
(1)①事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是___________(填序号,下同)。
a.C(s)+H2O(g)=CO(g)+H2(g) ΔH>0
b.2H2(g)+O2(g)=2H2O(l) ΔH<0
c.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH<0
②甲同学设计的原电池,若将石墨棒改为铁片,则总电极反应式是否改变,若是,写出改变后总的电极反应式,若否,请写出理由:_______________________。
③乙同学设计的原电池电极反应与甲的相同,但电池的效率高很多。乙同学设计的原电池两电极分别为:a是_______(填“铜片”“铁片”或“石墨棒”,下同),b是__________。负极的电极反应式为___________________,正极的电极反应式为____________________。
(2)关于乙同学设计的原电池,下列说法中错误的是____________。
a.实验过程中,左侧烧杯中Cl浓度增大
b.实验过程中取出盐桥,原电池不能继续工作
c.电子通过盐桥从右侧烧杯进入左侧烧杯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的相对位置如图所示,其中W元素的原子结构示意图为![]() 。请回答下列问题:
。请回答下列问题:

(1)Z元素位于元素周期表中第_______周期_______族。
(2)X元素的最简单气态氢化物能与其最高价氧化物对应的水化物反应,得到的化合物属于________ (填“离子化合物”或“共价化合物”)。
(3)X、Y、Z三种元素的原子半径由大到小的顺序为________(用元素符号表示)。
(4)写出W单质与X的最高价氧化物对应水化物的浓溶液反应的化学方程式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com