
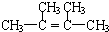 ;
;分析 (1)烃A分子中含有一个碳碳双键,为烯烃,设分子式为CnH2n,结合Mr(A)=84可计算分子式,从而确定其最简式;
(2)其核磁共振氢谱中只有一个吸收峰,则分子中只有一种类型的氢原子,则烃A为对称结构,进而推断结构简式;
(3)结合乙烯的平面结构确定碳原子共面问题.
解答 解:(1)烃A含有1个碳碳双键,则A应为烯烃,设其分子式为CnH2n,相对分子质量为84,则有:14n=84,解得:n=6,该有机物分子式为C2H4,最简式为CH2,
故答案为:CH2;
(2)该有机物分子的核磁共振氢谱中只有一个吸收峰,则其分子中只有一种类型的氢,故烃A为对称结构,即双键C原子上的4个H均被甲基取代,其结构简式应为: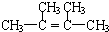 ,
,
故答案为: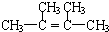 ;
;
(2)乙烯为平面结构,所以原子处于同一平面,而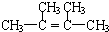 中甲基中C原子处于乙烯中H原子位置,故所有碳原子都处于同一平面,
中甲基中C原子处于乙烯中H原子位置,故所有碳原子都处于同一平面,
故答案为:是.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,试题侧重考查学生的分析能力及化学计算能力.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应制取H2后的溶液中:Na+、K+、AlO2-、Br- | |
| B. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| C. | 苯酚钠溶液:H+、HCO3-、SO2、K+ | |
| D. | 氢氧化铝胶体:H+、K+、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

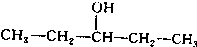 .
.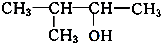 、
、 写出另外两种同分异构体的结构简式:
写出另外两种同分异构体的结构简式: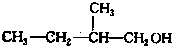 、
、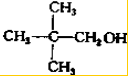 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
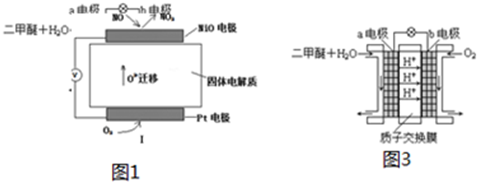
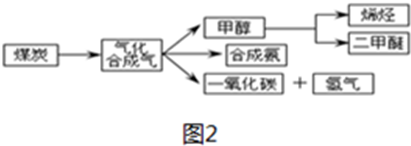
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃棒下端要靠在三层滤纸处 | |
| B. | 滤纸边缘低于漏斗边缘,多余部分要剪去,并用水润湿贴紧,不留气泡 | |
| C. | 过滤时将液体沿玻璃棒注入过滤器,并使液面高于滤纸边缘 | |
| D. | 漏斗下端紧靠烧杯内壁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com