
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
A.明矾溶液加热
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.小苏打溶液中加入少量NaCl固体
【答案】B
【解析】解:A.明矾溶液中电离后产生的Al3+水解使溶液呈酸性,加热导致水解程度增大,但酚酞遇酸性溶液颜色不变化,故A错误;B.CH3COONa为强碱弱酸盐,水解呈碱性,滴加酚酞后溶液显红色,加热使碱性增强,因此红色变深,故B正确;
C.氨水为弱碱,部分电离:NH3H2O ![]() NH4++OH﹣ , 加入酚酞后溶液变为红色,而NH4Cl=NH4++Cl﹣ , 其中的NH4+会抑制氨水的电离,使溶液碱性减弱,颜色变浅,故C错误;
NH4++OH﹣ , 加入酚酞后溶液变为红色,而NH4Cl=NH4++Cl﹣ , 其中的NH4+会抑制氨水的电离,使溶液碱性减弱,颜色变浅,故C错误;
D.加入少量NaCl固体不影响小苏打的电离,酚酞溶液不变深,故D错误.
故选B.
对滴有酚酞试液的下列溶液,操作后红色变深,说明溶液中OH﹣浓度增大,结合外界条件对水解平衡移动的影响分析.


科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)3c(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件. 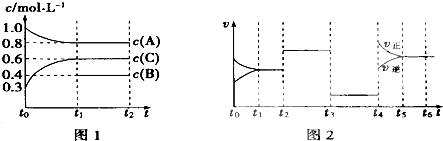
(1)若t1=15min,则t0~t1阶段以c的浓度变化表示的反应速率V(C)= .
(2)t3时改变的条件为 , B的起始物质的量为 .
(3)t4~t5阶段,若A的物质的量减少了O.01mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从柑桔中可炼制萜二烯( ![]() ),下列有关它的推测不正确的是( )
),下列有关它的推测不正确的是( )
A.分子式为C10H16
B.常温下呈液态难溶于水
C.所有原子可能共平面
D.与过量溴的CCl4 溶液反应后产物(如图)为: 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol LCaCl2溶液中滴加0.1mol L 的Na2CO3溶液,滴加过程中溶液中-lgc(Ca2+)与Na2CO3 溶液体积(V)的关系如图所示,下列有关说法正确的是

A. Z 点对应的分散系很稳定
B. w、x、y三点中,水的电离程度最大的为y点
C. 若用等浓度的Na2SO4 溶液代替Na2CO3 溶液,则图像在x点后的变化如虚线部分所示
D. Ksp(CaCO3])=5 x 10-10mol2/L2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是
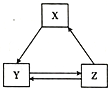
选项 | X | Y | Z |
A | NH3 | NO2 | HNO3 |
B | SiO2 | Na2SiO3 | H2SiO3 |
C | Al2O3 | NaAlO2 | Al(OH)3 |
D | CO2 | Na2CO3 | NaHCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入CH3COOH 或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是

A. 该温度下,醋酸的电离平衡常数Ka=![]()
B. a点对应的混合溶液中c(CH3COOH)>c(Na+)>c(OH-)
C. 水的电离程度:c>b>a
D. 当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、化学上常见的混合物分离或提纯的基本装置如下:

(1)写出仪器名称:a______,b______________。
(2)从海带提取碘的操作如下,除特殊说明外,请在空白处填上上图相应装置中的序号:将干海带进行灼烧,海带灰中含有较多KI,将海带灰溶于水,然后______得到澄清滤液;向滤液中加入硫酸和H2O2混合溶液,得到棕褐色含有单质碘的水溶液。该反应的离子方程式为:______________。向碘的水溶液中加入适量CCl4,进行______操作将上下两层溶液分开。将含有碘的CCl4溶液置于蒸馏烧瓶内进行_____操作,可以粗略从CCl4溶液中分离出碘。
Ⅱ、某同学需用480mL0.5mol/LNa2CO3溶液,在实验室进行配制。
(1)该同学用托盘天平应称量______gNa2CO3粉末,使用容量瓶前必须进行的一步操作是_____。
(2)下图是该同学配制过程的一些关键步骤和操作图。

配制过程的先后顺序为(用字母A--F填写)_______。
(3)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将_____(填“偏高”、“偏低”、“不变”);步骤F如果俯视刻度线,配得溶液的浓度将______(填“偏高”、“偏低”、“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产中用途广泛。
I.利用生产硼砂的废渣一一确镁泥(主要成分为MgCO3.SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3:Mg(OH)2:2H2O]的工业流程如下:

(1)写出“酸溶"一步中,MgCO3和硫酸反应的离子方程式_____________。
(2)滤渣2的主要成分有MnO2和____,写出生成MnO2的离子方程式__________。
(3)“合成”时需通蒸汽至80℃,边加热边搅拌,温度不能超80℃的原因是______________。
II.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:

已知:①CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓ ②+1价的Cu在酸性条件下易歧化
(4)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为________。
(5)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为______。
(6)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是______。(填离子符号)
(7)过滤3所得滤液中的CuCl2可循环使用,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-=CuS↓+H2S↑
B. Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+=Fe2++2Fe3++4H2O
C. 碳酸氢铵溶液与过量的苛性钾溶液混和共热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com