
科目:高中化学 来源: 题型:选择题
| A. | 根据气体的相对分子质量,不可以比较相同状况下气体密度的大小 | |
| B. | 根据甲烷和乙烷的熔点,不能比较二者晶体中的分子间作用力的大小 | |
| C. | 比较同主族金属元素原子半径的大小,可以推断元素的金属性强弱 | |
| D. | 根据液体密度的大小,可以判断液体的挥发性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4ab}{a{N}_{A}}$ | B. | $\frac{22.4ac}{b{N}_{A}}$ | C. | $\frac{22.4bc}{a{N}_{A}}$ | D. | $\frac{22.4b}{ac{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烷与NaOH溶液共热,在反应后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 在淀粉加入硫酸加热水解后的溶液中,直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 除去乙烯中杂质气体:将实验室制得的乙烯气体通入NaOH 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
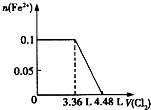 (1)向含有等物质的量的SO32-、Fe2+、Br-、I-的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系如图所示.
(1)向含有等物质的量的SO32-、Fe2+、Br-、I-的溶液中,通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量关系如图所示.| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| C. | 石油分馏、煤的干馏均为物理变化 | |
| D. | 淀粉、蛋白质和天然橡胶均是天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,FeCl3溶液中Fe3+与Cl-的个数之比等于1:3 | |
| B. | 利用Na2CO3溶液可除油污:CO32-+2H2O?H2CO3+2OH- | |
| C. | 常温时,0.1mol•L-1盐酸中由水电离出的c(H+)<10-7mol/L | |
| D. | 氯化钠溶于水发生电离,电离方程式为:NaCl$\frac{\underline{\;通电\;}}{\;}$Na++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将58.5gNaC1溶解于1L水中配成的溶液 | |
| B. | 将80gSO3溶于水并配成1L溶液 | |
| C. | 将100mI.0.5mol•L-1NaNO3溶液加热蒸发掉50g水之后的溶液 | |
| D. | 含2molK+的K2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com