
 �����������ƣ�Na2S2O4���ֳƱ��շۣ���ӡˢ��ҵ����Ҫ�Ļ�ԭ����ij����С���������ʵ�飮
�����������ƣ�Na2S2O4���ֳƱ��շۣ���ӡˢ��ҵ����Ҫ�Ļ�ԭ����ij����С���������ʵ�飮| ʵ�鲽�裨��Ҫ��д������������̣� | Ԥ�ڵ�ʵ������ͽ��� |
���� ��1�����ݵ��ӵ�ʧ�غ��ԭ���غ���д��ѧ����ʽ����������������һ�ְ�ɫ��ĩ��������ˮ���������Ҵ���
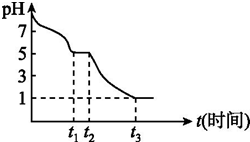
��1����Һ�����ԣ�HSO3-�ĵ���̶ȴ���ˮ��̶ȣ�Na2S2O4��Һ�ڿ������ױ������������������ƣ�t3ʱ��Һ��pH=1��˵����Һ�����Խ�ǿ��������������Ʊ�����Ϊ�������ƣ�
��2��������������Na2S2O4������ȫ�ֽ⣬�õ��������Na2SO3��Na2S2O3�����壬�����������������������Na2S2O3��S��+2�ۣ������������ԭ��Ӧ�е��ӵ�ʧ�غ��֪����Ӧ����SO2�����ݷ�ӦNa2S2O3+2HCl=2NaCl+S��+SO2��+H2O��֪Ҫ������������ƣ�
��� �⣺��1����Ӧ��SԪ�صĻ��ϼ۴�+4�۽��͵�+3�ۣ��õ�1�����ӣ���������̼Ԫ�صĻ��ϼ۴�+2�����ߵ�+4�ۣ�����ݵ��ӵ�ʧ�غ��ԭ���غ��֪��Ӧ�Ļ�ѧ����ʽΪ2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O����������������һ�ְ�ɫ��ĩ��������ˮ���������Ҵ�����˿������Ҵ�ϴ�Ӳ�Ʒ��
�ʴ�Ϊ��2HCOONa+Na2CO3+4SO2=2Na2S2O4+3CO2+H2O���Ҵ���
��1��Na2S2O4��Һ�ڿ������ױ������������������ƣ���0��t1�η������ӷ�Ӧ����ʽΪ 2S2O42-+O2+2H2O=4HSO3-��0��t1����Ҫ������HSO3-����Һ�����ԣ�HSO3-�ĵ���̶ȴ���ˮ��̶ȣ�t3ʱ��Һ��pH=1��˵����Һ�����Խ�ǿ��������������Ʊ�����Ϊ�������ƣ�����Һ����Ҫ�����ӷ�����SO42-���ʴ�Ϊ������2S2O42-+O2+2H2O=4HSO3-��SO42-��
��2��������������Na2S2O4������ȫ�ֽ⣬�õ��������Na2SO3��Na2S2O3�����壬�����������������������Na2S2O3��S��+2�ۣ������������ԭ��Ӧ�е��ӵ�ʧ�غ��֪����Ӧ����SO2�����ݷ�ӦNa2S2O3+2HCl=2NaCl+S��+SO2��+H2O��֪Ҫ������������ƣ���ֻ��Ҫȡ������ȫ�ֽ�Ĺ���������Թ��У�����ϡ���ᣬ����е���ɫ����������Na2S2O3���ڣ��ʴ�Ϊ��SO2��
| ʵ�鲽�裨��Ҫ��д������������̣� | Ԥ�ڵ�ʵ������ͽ��� |
| ȡ������ȫ�ֽ�Ĺ���������Թ��У�����ϡ���� | ���е���ɫ����������Na2S2O3���� |
���� ���⿼��������ԭ��Ӧ��ˮ�ⷴӦ�������Ʊ��ͼ���ʵ�������̽�����漰�Է�Ӧԭ����װ�ü������ķ������ۡ����ӷ���ʽ����д�ȣ�ע�������������Ϣ��Ӧ�ã��Ѷ��еȣ�


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
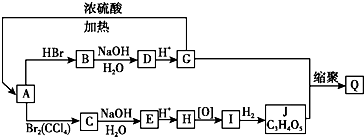
 ��ͼ��ʾ���ʵ�ת����ϵ�У�D�ڳ�����Ϊ��ɫ��ζ��Һ�壨��Ӧ��������ʡ�ԣ�����ش��������⣺
��ͼ��ʾ���ʵ�ת����ϵ�У�D�ڳ�����Ϊ��ɫ��ζ��Һ�壨��Ӧ��������ʡ�ԣ�����ش��������⣺ ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
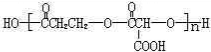 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
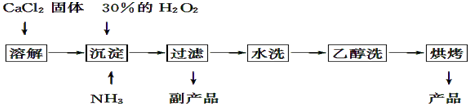
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
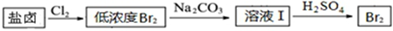
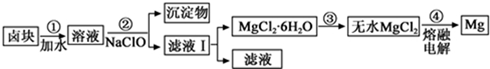
| ���� | ��ʼ���� | ������ȫ |
| Fe��OH��3 | 2.7 | 3.7 |
| Fe��OH��2 | 7.6 | 9.6 |
| Mn��OH��2 | 8.3 | 9.8 |
| Mg��OH��2 | 9.6 | 11.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
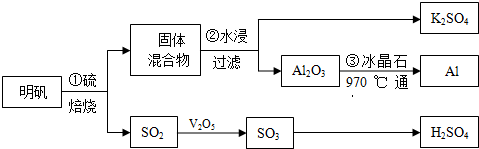
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com