
【题目】常温下,现有 0.1 mol·L-1的 NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是

A. 当溶液的 pH=9 时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3 ·H2O)>c(CO32-)
B. NH4HCO3 溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C. 往该溶液中逐滴滴加氢氧化钠时,NH4+和 HCO3-浓度均逐渐减小
D. 通过分析可知常温下 Kb(NH3·H2O)大于 Ka1(H2CO3)
【答案】D
【解析】
试题A、根据示意图可知,当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-),A错误;B、根据物料守恒可得NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(CO32-)+c(H2CO3)+c(HCO3-),因为NH4+发生水解反应,所以c(HCO3-)≠c(CO32-)+c(OH-)—c(H+),则B项中关系式错误,B错误;C、根据图像可知pH<7.8时,往该溶液中逐滴滴加氢氧化钠HCO3﹣浓度逐渐增大,C错误;D、因为0.1mol/L的NH4HCO3溶液pH=7.8,说明HCO3的水解程度大于NH4+的水解程度,根据越弱越水解的规律可得:Kb(NH3·H2O)>Ka1(H2CO3),D正确。答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】镁—空气电池是最常见也是最常用的一种镁燃料电池,电池构造如图所示,下列说法不正确的是
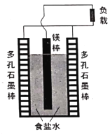
A.电池工作时![]() 、
、![]() 向两侧移动
向两侧移动
B.电池总反应是:![]()
C.该电池因存在![]() 副反应,导致性能降低
副反应,导致性能降低
D.多孔石墨电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
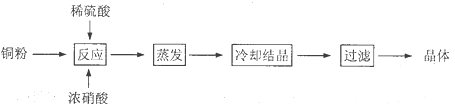
根据题意完成下列填空:
(1)理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为___。
(2)实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是___。
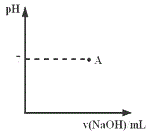
(3)请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。____
(4)上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是___。
A.醋酸 B.草酸 C.苯甲酸 D.苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确的是
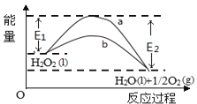
A. 有MnO2 条件下的反应曲线是a曲线
B. 该反应能量变化类型与CaCO3分解反应相同
C. 加催化剂后,正反应速率加快,逆反应速率减小
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= ( E1 - E2 )kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为![]() 。
。
阳离子 |
|
阴离子 |
|
甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在无色火焰上灼烧,未出现黄色火焰
②取少量溶液,加入![]() 溶液无明显变化。
溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入![]() 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
(1)步骤①使用的焰色反应属于___(填“物理”或“化学”)变化
(2)③中加入少量盐酸生成无色气体的离子方程式是____
(3)该溶液中一定含有的阳离子有___,一定含有的阴离子有___
(4)检验溶液中存在![]() 的方法是_____
的方法是_____
(5)取![]() 该溶液,向溶液中加入过量的稀氢氧化钠溶液,充分反应后,过滤、洗涤,将沉淀在空气中灼烧后得到的固体质量为___g
该溶液,向溶液中加入过量的稀氢氧化钠溶液,充分反应后,过滤、洗涤,将沉淀在空气中灼烧后得到的固体质量为___g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定体积 CaCl2 和 HCl 的混合溶液中逐滴加入浓度为 1.00mol·L-1的 Na2CO3溶液,反应过程中加入的 Na2CO3 溶液的体积与产生沉淀或气体的质量关系如图所示。
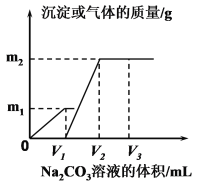
已知:图中 V1 :V2=1:2,当加入 V2mL Na2CO3溶液时,所得溶液的浓度为 1.00 mol·L-1,体积为 200mL。求:
(1)混合溶液中 CaCl2和 HCl 物质的量之比n(CaCl2)∶n(HCl)=_______(2)m2=______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为 0.1 mol·L-1 的盐酸和醋酸,下列说法正确的是
A. 两种溶液的 pH:盐酸大于醋酸
B. 用相同浓度的 NaOH 溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的 NaOH溶液体积多
C. 向醋酸中加入等物质的量的 NaOH,溶液呈碱性,且溶液中 ![]()
D. 两种溶液中水电离出的氢离子:盐酸大于醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水星大气中含有一种被称为硫化羰(化学式为COS)的物质。已知硫化羰与CO2的结构相似,但能在O2中完全燃烧,下列有关硫化羰的说法正确的是( )
A. 硫化羰的电子式为![]() B. 硫化羰分子中三个原子位于一条折线上
B. 硫化羰分子中三个原子位于一条折线上
C. 硫化羰的沸点比二氧化碳的低D. 硫化羰在O2中完全燃烧后的产物是CO2和SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com