
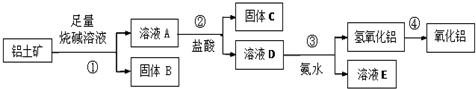
分析 向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱,只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,加入盐酸生成硅酸和氯化铝,氯化铝溶液中滴入氨水生成氢氧化铝,氢氧化铝受热分解,生成氧化铝,由此分析解答.
(1)氧化铁为红色,简称铁红,可用作涂料、油漆等;
(2)向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱.只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸,则在①得到滤液中含有偏铝酸根离子、硅酸根离子;
(3)试剂③为氨水,将铝离子转化为氢氧化铝沉淀.加热分解得氧化铝;若往A溶液中通入足量CO2,硅酸根离子和偏铝酸根离子反应生成硅酸和氢氧化铝;
(4)Cl2有强氧化性,将C氧化为CO,自身被还原为C1-,根据得失电子守恒解答;
(5)所得氢氧化铝固体的质量与原铝土矿质量相等,这说明铝土矿中Al2O3的质量分数和氢氧化铝中氧化铝的质量分数是相同,分析求解.
解答 解:(1)向铝土矿中加入足量烧碱溶液后,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁,氧化铁可作为炼铁的原料,氧化铁为红色,可用作涂料、油漆等,
故答案为:炼铁原料、用作涂料、油漆等;
(2)根据框图流程,向铝土矿中加入足量烧碱溶液后,氧化铝是两性氧化物,既溶液强酸又溶于强碱.只Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸,则在①得到滤液中含有偏铝酸根离子、硅酸根离子,滤渣为氧化铁氧化铁和氢氧化钠溶液不反应,
则向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;SiO2+2OH-=SiO32-+H2O;
(3)试剂③为氨水,将铝离子转化为氢氧化铝沉淀.离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;若往A溶液中通入足量CO2,硅酸根离子和偏铝酸根离子反应生成硅酸和氢氧化铝,反应的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-和SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-;故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-和SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-;
(4)Cl2有强氧化性,碳具有还原性,每消耗0.5 mol 碳单质,转移1mol电子,这说明反应中碳失去2个电子,即氧化产物是CO,所以反应的化学方程式是Al2O3+3Cl2+3C$\frac{\underline{\;高温\;}}{\;}$2AlCl3+3CO,
故答案为:Al2O3+3Cl2+3C$\frac{\underline{\;高温\;}}{\;}$2AlCl3+3CO;
(5)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,说明所得氢氧化铝固体的质量与原铝土矿质量相等,即铝土矿中Al2O3的质量分数和氢氧化铝中氧化铝的质量分数是相同的.又因为氧化铝可以写成Al2O3•3H2O的形式,所以质量分数是$\frac{102}{102+54}$×100%=65.4%,
答:铝土矿中Al2O3的质量分数为65.4%.
点评 本题以框图题形式考查铝的化合物的性质,清楚提取的操作过程原理,能熟练对知识迁移进行综合运用是解答的关键,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | Al3+ | C. | Fe2+ | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质遇浓硝酸变黄 | |
| B. | 含钠元素的物质在火焰上灼烧产生黄色火焰 | |
| C. | pH试纸与某溶液接触变为红色 | |
| D. | 无色浓硝酸久置后变黄 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将试剂瓶中的Na2CO3溶液倒入试管,发现取量过多,将过量的试剂倒回试剂瓶中 | |
| B. | 将含有Ba(NO3)2的废液倒入指定的容器中回收 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,立刻转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| B. | 金属阳离子被还原不一定得到金属单质 | |
| C. | 铝在纯氧气中能剧烈燃烧,火星四射,生成熔融的氧化铝 | |
| D. | 生铁、普通钢和不锈钢中的含碳量依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com