
| A. | 常温下,向0.1mol/LNH4HSO4溶液中滴加NaOH溶液至中性C(Na+)>c(SO42-)>c(NH4+)>c(OH-)=C(H+) | |
| B. | 向饱和NaClO溶液中滴加少量饱和FeSO4溶液,反应的离子方程式为2Fe2++ClO-+5H2O═2Fe(OH)3↓+Cl-+4H+ | |
| C. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH2COO-)-c(CH2COOH) | |
| D. | 常温下cmol/L、电离常数为Ka的酸HA溶液中,由水电离的浓度为c(H+)水=$\frac{1{0}^{-14}}{\sqrt{Ka•c}}$mol•L-1 |
分析 A.向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,溶质为等物质的量的(NH4)2SO4和Na2SO4,溶液呈酸性,再滴加少许NaOH呈中性;
B.向饱和NaClO溶液中滴加少量饱和FeSO4溶液,溶液显碱性;
C.0.2mol•L-1CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合得到等浓度的醋酸钠和醋酸混合溶液,电离大于醋酸根离子水解溶液呈酸性,结合电话守恒和物料守恒判断;
D.一元弱酸溶液中c(H+)=$\sqrt{Ka×c}$,水溶液中存在离子积常数.
解答 解:A.NH4HSO4中滴加NaOH溶液,若二者物质的量相同时,溶质为等物质的量的(NH4)2SO 4和Na2SO 4,溶液呈酸性,需要再滴加少许NaOH呈中性,c(Na+)+c(NH4+)=2c(SO42-),故溶液中离子浓度大小关系为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故A正确;
B.NaClO溶液呈碱性,在NaClO溶液中滴入少量FeSO4溶液,发生3H2O+3ClO-+6Fe2+=2Fe(OH)3↓+4Fe3++3Cl-,故B错误;
C.由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由物料守恒可知,c(CH3COOH)+c(CH3COO-)=2c(Na+),得到2c(H+)-2c(OH-)=c(CH2COO-)-c(CH2COOH),故C正确;
D.常温下cmol/L、电离常数为Ka的酸HA溶液中,c(H+)=$\sqrt{Ka×c}$,由水电离的浓度为c(H+)水=c(OH-)水=$\frac{1{0}^{-14}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{\sqrt{Ka×c}}$mol/L,故D正确;
故选B.
点评 本题考查了盐类水解、电解质溶液中电荷守恒和物料守恒计算、弱电解质电离平衡常数计算,掌握基础是解题关键,题目难度中等.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 一切物质中都存在化学键 | |
| B. | 含有共价键的物质是共价化合物 | |
| C. | 由非金属元素组成的化合物是共价化合物 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
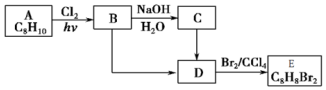
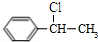 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$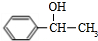 +NaCl;
+NaCl;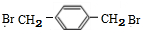 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 【系列一】实验 | 溶液X | 实验现象 | |
| 实验Ⅰ | 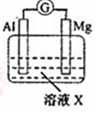 | 1mol/L稀硝酸 | 观察到电流计指针向左偏转. |
| 实验Ⅱ | 6mol/L稀硝酸 | 观察到电流计指针向左偏转,铝片表面产生无色气体,在液面上方变为红棕色 | |
| 实验Ⅲ | 6mol/LNaOH溶液 | 观察到(现象写在答题处). | |
| 实验Ⅳ | 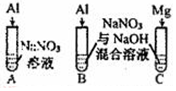 | A、C中均无明显现象,B中有无色气体生成. | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8×l0-7mol/L | B. | 1.0×l0-5mol/L | C. | 1.0×l0-7mol/L | D. | 1.8×l0-9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子从电极a经电解质溶液流向电极b | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 放电一段时间后,正极消耗的OH-和负极生成的OH-的量相等 | |
| D. | 电池的负极反应为BH4--8e-+8OH-=BO2+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com