
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是()
A. 26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA
B. 1mol甲基(﹣CH3)所含电子数为9NA
C. 标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数约为16NA
D. 标准状况下,1L庚烷所含有的分子数为NA/22.4
考点: 阿伏加德罗常数.
分析: A.C2H2和苯蒸气的混合气体最简式相同为CH,计算26gCH中含原子数;
B.1个甲基含有9个电子;
C.B2H6和C2H4中都含有16个电子;
D.气体摩尔体积只适用与气体.
解答: 解:A.C2H2和苯蒸气的混合气体最简式相同为CH,计算26gCH中含原子数= ×1×NA=2NA,故A正确;
×1×NA=2NA,故A正确;
B.1个甲基含有9个电子,1mol甲基(﹣CH3)所含电子数为9NA,故B正确;
C.B2H6和C2H4中都含有16个电子,标准状况下,B2H6和C2H4的混合气体22.4L的物质的量为1mol,含有电子数为16NA,故C正确;
D.标况下庚烷为液体,不能使用气体摩尔体积,故D错误;
故选:D.
点评: 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下庚烷不是气体是解题关键,题目难度不大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
X、Y、R、Q是短周期元素,R、Q和X、Y分别处于同一周期,R、Y处于同一主族,Q2﹣和X2+具有相同的电子层结构,其中Q是地壳中含量最高的元素,R最外层电子数是次外层的2倍.下列说法正确的是()
A. 离子半径:Q2﹣>X2+
B. 原子序数:Y>R>Q
C. 简单气态氢化物的稳定性:R>Q>Y
D. 原子最外层电子数:X>Y>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.
已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol﹣1,
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534kJ•mol﹣1.
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式: .
(2)已知:N≡N的键能是946kJ•mol﹣1,H﹣H的键能为436kJ•mol﹣1,N﹣H的键能为393kJ•mol﹣1,计算合成氨反应生成1molNH3的△H= kJ•mol﹣1.
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为
②加水稀释100倍,所得溶液中由水电离出c(OH﹣)=
③与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11,该盐酸溶液的pH= .
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO﹣)(填“>”或“=”或“<”).
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO﹣).
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下氨气和氧化铜可以发生如下反应:2NH3+3CuO 3Cu+N2+3H2O,下列对此反应的分析中合理的是()
3Cu+N2+3H2O,下列对此反应的分析中合理的是()
A. 该反应属于置换反应
B. CuO是氧化剂
C. 反应体现了金属铜的还原性
D. 每生成1molH2O就伴随着1mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大.
(1)已知25℃时:SO2(g)+2CO(g)═2C02(g)+ Sx(s)△H=a kJ•mol﹣1;
Sx(s)△H=a kJ•mol﹣1;
2COS(g)+SO2(g)═2CO2(g)+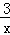 Sx(s)△H=b kJ•mol﹣1.则CO与Sx生成COS反应的热化学方程式是 .
Sx(s)△H=b kJ•mol﹣1.则CO与Sx生成COS反应的热化学方程式是 .
(2)有人设想按如图甲所示装置用废气中的SO2生产硫酸.写出SO2电极的电极反应式 .
(3)提高反应2SO2(g)+O2⇌2SO3(g)△H<0中SO2的转化率是控制SO2排放的关键措施之一.某课外活动小组进行了如下探究:
①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5min后反应达到平衡,二氧化硫的转化率为
50%,前5min内SO2的平均反应速率为 .
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是 (填序号).
a温度和容器体积不变,充入1.0molHe (g)
b温度和容器体积不变,充入2molSO2和lmolO2
c温度和容器体积不变,充入1.0molSO2
d在其他条件不变时,减小容器的容积
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g)⇌2SO3(g)反应的影响,实验结果如
图乙所示.(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的
是 ,温度T1 T2(填“>”“<”或“一”).

查看答案和解析>>
科目:高中化学 来源: 题型:
柠橡稀是一种食用香料,其结构为; 有关柠檬烯的分析正确的是()
有关柠檬烯的分析正确的是()
A. 柠檬烯的一氯代物有9种
B. 柠檬烯和丁基苯( )互为同分异构体
)互为同分异构体
C. 柠檬烯的分子中所有的碳原子可能在同一个平面上
D. 一定条件下,柠檬烯可以发生加成、取代、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A~G是几种烃的分子球棍模型(如图)

据此回答下列问题:
(1)常温下含碳量最高的气态烃是 (填对应字母).
(2)能够发生加成反应的烃有(填数字) 种.
(3)一卤代物种类最多的是(填对应字母) .
(4)写出实验室制取C的化学方程式 .
(5)写出F发生溴代反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有________(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
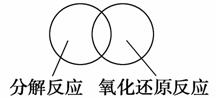
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-===H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO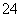 ===BaSO4↓”来表示,请写出有关反应的化学方程式(3个):
===BaSO4↓”来表示,请写出有关反应的化学方程式(3个):
①_______________________________________________________________;
②_______________________________________________________________;
③_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列广告语中,你认为符合科学道理的是 ( )。
A.“超纯水”“超纯蒸馏水”绝对卫生,对人体有益
B.本饮料由纯天然物质配制而成,绝对不含化学物质,对人体无害
C.含氟牙膏可以预防龋齿
D.含碘食盐可防止贫血
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com