
如图每一方框中的字母代表一种反应物或生成物。产物J是含金属元素A的白色胶状沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白。

(1)框图中所列物质中属于非电解质的物质的化学式是 。
(2)用电子式表示出H的形成过程 。
(3)将E的水溶液蒸干并灼烧得到的固体物质的化学式为 。
(4)F的水溶液中各离子浓度由大到小的顺序为 。
(5)F的水溶液显碱性的原因: (用离子方程式表示)。
(6)E与F在L中反应的离子方程式为 。
(7)H和G之间反应的化学方程式为 。
(1)SO2
(2) 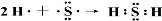
(3)Al2O3
(4)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
(5)S2-+H2O??HS-+OH-
(6)2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
(7)2H2S+SO2=3S↓+2H2O
【解析】根据J是含金属元素A的白色胶状沉淀,可推断出A是Al,J是Al(OH)3;根据D是淡黄色固体单质,可推断出D为S。从图示转化关系知,E是含铝的化合物,F是含硫的化合物,结合I为NaCl溶液,可以推断出E是AlCl3、F是Na2S、L是H2O,则B 为Cl2,C为Na。G是SO2,结合SO2的性质及G与H的反应,可推断出H是H2S。(1)框图中只有SO2为非电解质。(3)AlCl3蒸干时水解得到Al(OH)3,灼烧最终得到Al2O3。(4)Na2S溶液中由于S2-水解溶液显碱性,离子浓度大小为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。(5)S2-水解的离子方程式为S2-+H2O HS-+OH-。(6)Al3+与S2-发生相互促进的水解反应:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。(7)该反应为硫元素的归中反应:2H2S+SO2=3S↓+2H2O。
HS-+OH-。(6)Al3+与S2-发生相互促进的水解反应:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。(7)该反应为硫元素的归中反应:2H2S+SO2=3S↓+2H2O。


科目:高中化学 来源:2014福建安溪一中、养正中学、惠安一中高一下学期期末化学试卷(解析版) 题型:选择题
相同状况下,在容积相同的三个烧瓶内分别充满干燥的NH3、HCl、NO2气体,做喷泉实验,所得三种溶液的物质的量浓度比为( )
A.3∶3∶2 B.2∶2∶3
C.1∶1∶1 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版4.3铜及其化合物 金属材料与复合材料练习卷(解析版) 题型:选择题
已知下列转化关系中,M、N均为单质,则M可能是( )。
M+N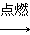 Q
Q Q溶液
Q溶液 M+N
M+N
A.Na B.Al C.Fe D.Cu
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版3.4海水中的元素练习卷(解析版) 题型:填空题
下图是关于药物华素片(西地碘片)的使用说明书,以下为说明书的部分内容:
华素片(西地碘片)使用说明书 【品名或组成】 品名:西地碘片 组成:华素片 英文名:Cydiodine Tablets 华素片(西地碘片)的主要活性成分是分子碘,含量1.5 mg/片。将碘利用分子分散技术制成分子态西地碘,并含适量薄荷脑等 【贮藏】 遮光、密闭、阴凉处保存 【有效期】 二年 |
(1)根据上述说明和所学知识回答:
①华素片中含有的活性成分是 (写分子式)。
②请推断华素片 (填“是”或“不是”)白色。
(2)某学生为验证华素片中确实含有上述成分,设计实验如下。请填空:
①取一粒药片放入研钵中研碎,再将药粉装入试管并加入约2 mL蒸馏水;向试管中再加入约2 mL (填选项字母),并用力振荡。
A.酒精(密度比水小,与水以任意比混溶)
B.四氯化碳(密度比水大,不溶于水)
②描述加入该液体后可能观察到的现象 。
③选用该液体的原因是 。
(3)请再设计另一种方法,验证华素片中的成分(请叙述实验原理、操作方法和实验结论) 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版3.4海水中的元素练习卷(解析版) 题型:选择题
粗碘中通常含ICl和IBr,称为卤素互化物,其性质和卤素单质相似,都是较强的氧化剂,而且受热时ICl和IBr皆可像I2一样升华,在粗碘中加入以下选项中的一种物质后,再进行升华可制得精碘,应加入的物质是( )。
A.H2O B.Zn C.KI D.KCl
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版3.3硫的转化练习卷(解析版) 题型:选择题
对下列事实的解释正确的是( )。
A.二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性
B.医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于酸
C.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol
D.常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版3.2氮的循环练习卷(解析版) 题型:填空题
工业上可用铜屑和浓硝酸为原料制取硝酸铜。在实际生产中,先把铜屑在空气中灼烧,再跟用等体积水稀释的浓硝酸反应来制取硝酸铜。请回答下列问题:
(1)不宜于用铜屑直接与硝酸反应来制取硝酸铜的原因是 。
(2)浓硝酸用等体积水稀释的目的是 。
(3)要得到硝酸铜晶体,应选用 。
(4)反应中硝酸表现出 性。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版3.1碳的多样性练习卷(解析版) 题型:选择题
中科院用CO2合成了可降解塑料聚二氧化碳。下列相关说法合理的是( )。
A.聚二氧化碳塑料是通过聚合反应制得的
B.聚二氧化碳塑料与干冰互为同素异形体
C.聚二氧化碳塑料与干冰都属于纯净物
D.聚二氧化碳塑料的使用会产生白色污染
查看答案和解析>>
科目:高中化学 来源:2014年高考化学鲁科版1.1钠及其重要化合物练习卷(解析版) 题型:选择题
下列关于钠及其化合物的叙述正确的是 ( )。
A.将足量的Na2O2和Na2O分别加入酚酞试液中,最终溶液均为红色
B.用钠与空气反应制纯净的Na2O2,空气必须经过碱石灰处理后,才能与钠反应
C.钠与钠离子都具有强还原性
D.在Na2O2与CO2的反应中,氧化剂是Na2O2,还原剂是CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com