
【题目】I.二甲醚是一种重要的清洁燃料.合成二甲醚是解决能源危机的研究方向之一.
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
已知:CO(g)+2H2(g)═CH3OH(g)△H1=﹣90.1kJ/mol
CO(g)+H2O(g)═CO2(g)+H2(g)△H2=﹣41.1kJ/mol
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H3=﹣24.5kJ/mol
则反应2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=____________.
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率.利用二甲醚酸性介质燃料电池电解200mL饱和食盐水(惰性电极),电解一段时间后,阴极收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的正极反应式为_____________________________.
②请写出电解食盐水的化学方程式____________________.
③电解后溶液的pH=_________.
II.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
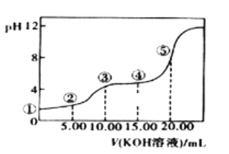
(3)点③所示溶液中所有离子的浓度由大到小的顺序为:___________________。点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O422-)=________mol/L。
【答案】﹣122.5 kJ·mol﹣1 O2+4e﹣+4H+=2H2O 2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 14 c(K+)>c(HC2O4―)>c(H+)>c(C2O42-)>c(OH―) 0.10
2NaOH+Cl2↑+H2↑ 14 c(K+)>c(HC2O4―)>c(H+)>c(C2O42-)>c(OH―) 0.10
【解析】
I.(1)利用盖斯定律计算所需热化学方程式;
(2))①原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳碳,正极是氧气得到电子在酸性溶液中生成水,结合电荷守恒和原子守恒书写电极反应;
②电极饱和食盐水生成氢氧化钠、氯气和氢气;
③根据电解氯化钠溶液的电解方程式来求溶液的pH,结合电极反应和电子守恒计算消耗二甲醚的质量.
II.(3)点③时两溶液恰好完全反应生成了KHC2O4,溶液显酸性,HC2O4-的电离程度大于水解程度;
(4)结合物料守恒进行分析;
:(1)利用盖斯定律进行计算,将三个方程式进行形式变换,
①CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ/mol
②CO(g)+H2O(g)═CO2(g)+H2(g)△H2=-41.1kJ/mol
③2CH3OH(g)═CH3OCH3(g)+H2O(g)△H3=-24.5kJ/mol
盖斯定律计算①×2-2×②+③得到:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)△H=-122.5 kJmol-1,故答案:-122.5 kJmol-1;
(2))①正极上是氧气得到电子发生还原反应,在酸性溶液中生成生成水,故答案为:O2+4e-+4H+=2H2O;
②电极饱和食盐水阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气,同时溶液中生成氢氧化钠,故答案为:![]() ;
;
③生成的氢气为2.24L(标况)即为0.1mol,根据点解方程式可知此过程中生成氢氧根0.2mol,忽略溶液的体积变化,则c(OH-)=0.2mol/200mL=1mol/L,故pH值为14,故答案为:14;
II.(3)点③时两溶液恰好完全反应生成了KHC2O4,溶液显酸性,HC2O4-的电离程度大于水解程度,则溶液中离子浓度关系为:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(4)点④所示的溶液的体积25mL,根据物料守恒:c(HC2O4-)+c(H2C2O4)+c(C2O42-)=0.10mol/L×![]() =0.04mol/L;c(K+)=0.10mol/L×
=0.04mol/L;c(K+)=0.10mol/L×![]() =0.06mol/L,所以c(HC2O4-)+c(H2C2O4)+c(C2O42-)+c(K+)=0.10molL-1,故答案为:0.10;
=0.06mol/L,所以c(HC2O4-)+c(H2C2O4)+c(C2O42-)+c(K+)=0.10molL-1,故答案为:0.10;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(气)+3B(气)![]() 2C(气)达到平衡的标志是( )
2C(气)达到平衡的标志是( )
A. C的生成速率与B的生成速率相等B. A、B、C的浓度不再发生变化
C. A、B、C的分子数之比为1∶3∶2D. 单位时间内消耗nmolA,同时消耗3nmolB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中NO3- 达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3 -的浓度,某兴趣小组提出如下方案:
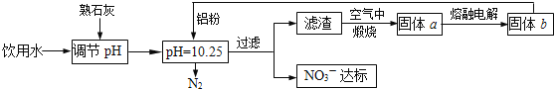
请回答下列问题:
(1)该方案中选用熟石灰调节 pH,理由是_______、__________、________, 在调节pH时,若pH过大或过小都会造成________的利用率降低。
(2)已知过滤后得到的滤渣是Al和Al(OH)3,则在溶液中铝粉和NO3-反应的离子方程式为____________________________________。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物 均可参与大气循环,则催化还原法的离子方程式为____________________________________。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用下,NH4+经过两步反应被氧化 成NO3-。两步反应的能量变化示意图如下:

试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的![]() 、
、![]() 等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)![]() 和
和![]() 在空气中存在下列平衡:
在空气中存在下列平衡:
![]() ;
;
![]()
![]()
![]() 通常在
通常在![]() 的存在下,进一步被氧化,生成
的存在下,进一步被氧化,生成![]() 。写出
。写出![]() 和
和![]() 反应的热化学方程式为______。
反应的热化学方程式为______。
(2)烟气中的![]() 可以用NaOH溶液吸收,将所得的
可以用NaOH溶液吸收,将所得的![]() 溶液进行电解,可循环再生NaOH,同时得到
溶液进行电解,可循环再生NaOH,同时得到![]() ,其原理如图所示。
,其原理如图所示。![]() 电极材料为石墨
电极材料为石墨![]()
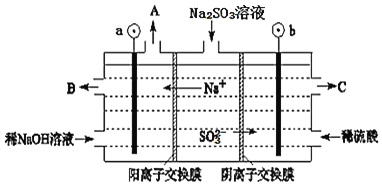
①图中a极要连接电源的______![]() 填“正”或“负”
填“正”或“负”![]() 极,C口流出的物质是______。
极,C口流出的物质是______。
②![]() 放电的电极反应式为______。
放电的电极反应式为______。
(3)常温下,烟气中![]() 被NaOH溶液吸收可得到
被NaOH溶液吸收可得到![]() 、
、![]() 等。
等。
①已知![]() 水溶液显碱性,原因是______
水溶液显碱性,原因是______![]() 写出主要反应的离子方程式
写出主要反应的离子方程式![]() ,该溶液中
,该溶液中![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]()
②常温下,![]() 的
的![]() 溶液的
溶液的![]() ,则
,则![]() ______
______![]() 填写准确数值
填写准确数值![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究石蜡油裂解产物,设计如图实验。下列说法正确的是( )
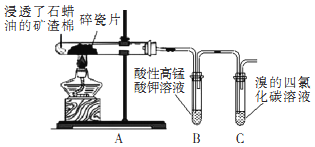
A.本实验能证明其产物含有碳碳不饱和键
B.两支试管中发生的反应类型相同
C.可观察到B和C试管中液体褪色和分层
D.实验完毕后先熄灭酒精灯后拆导管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.分子式为C4H8和C2H4的物质一定互为同系物
B.苯乙烯(![]() )使酸性KMnO4溶液和溴水褪色的原理相同
)使酸性KMnO4溶液和溴水褪色的原理相同
C.室温下在水中的溶解度:乙醇>环己烷
D.在酸性条件下,C2H5CO18OC2H5的水解产物是C2H5CO18OH和C2H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
A.在测定中和热的实验中,至少需要测定并记录的温度是3次
B.同温同压下,![]() 在光照和点燃条件下的
在光照和点燃条件下的![]() 不同
不同
C.一定条件下,某可逆反应的![]() ,则正反应活化能大于
,则正反应活化能大于![]()
D.已知![]()
![]() ,则碳的燃烧热为
,则碳的燃烧热为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述,正确的是
A.若2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则1mol碳完全燃烧放出的热量大于110.5kJ
B.若CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-812.3kJ/mol,则甲烷的燃烧热为812.3kJ/mol
C.若2NO2(g)![]() N2O4(g) ΔH=56.9kJ·mol-1,则2molNO2(g)置于密闭容器中充分反应吸收热量为56.9kJ
N2O4(g) ΔH=56.9kJ·mol-1,则2molNO2(g)置于密闭容器中充分反应吸收热量为56.9kJ
D.若H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,含1 mol CH3COOH的溶液与含1molNaOH的溶液混合,放出热量为57.3kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com